Conoce
Quiénes Somos
Nuestra Oferta
Académica
Ingenio
vocación y
aspiración
a la excelencia
- Administración y Negocios Digitales
- Ciencia de Datos
- Ciencia de la Computación
- Bioingeniería
- Ingeniería Ambiental
- Ingeniería Civil
- Ingeniería de la Energía
- Ingeniería Electrónica
- Ingeniería Industrial
- Ingeniería Mecánica
- Ingeniería Mecatrónica
- Ingeniería Química
- Sistemas de Información
- Blog de carreras
- Bienestar Estudiantil
- Repositorio Proyectos Interdisciplinarios
- Postula
Experiencia
en Investigación
- Dirección de Investigación
- Centro de Investigación y Tecnología del Agua
- Centro de Investigación en Bioingeniería
- Centro de Investigación y Conservación del Patrimonio
- Centro de Impacto y Responsabilidad Social
- Centro de Investigación del Cemento y Concreto
- Centro de Investigación en Computación Sostenible
- Investigadores
- Proyectos
- CRIS UTEC
Sostenibilidad UTEC
- Gobernanza ambiental
- Gestión ambiental
- Formación
- Eventos
- Investigación
- Proyección social
Conoce
Quiénes Somos
La universidad que potencia el ingenio, la innovación y el emprendimiento.
Nuestra Oferta
Académica
Nuestros estudiantes experimentan la ingeniería, la computación y los negocios desde el día uno a través de nuestra metodología de aprendizaje activo
Ingenio
vocación y
aspiración
a la excelencia
Ese es el ADN de nuestros estudiantes: alcanzar el más alto nivel académico y desarrollo personal.
Experiencia
en Investigación
El paso decisivo para encontrar las mejores soluciones.
Sostenibilidad UTEC
Informes de sostenibilidad
contacto:
Giancarlo Marcone
DIRECTOR DE HACS
gmarcone@utec.edu.pe
- Gobernanza ambiental
- Gestión ambiental
- Formación
- Eventos
- Investigación
- Proyección social
Conoce
Quiénes Somos
La universidad que potencia el ingenio, la innovación y el emprendimiento.
Nuestra Oferta
Académica
Nuestros estudiantes experimentan la ingeniería, la computación y los negocios desde el día uno a través de nuestra metodología de aprendizaje activo
Ingenio
vocación y
aspiración
a la excelencia
Ese es el ADN de nuestros estudiantes: alcanzar el más alto nivel académico y desarrollo personal.
Experiencia
en Investigación
El paso decisivo para encontrar las mejores soluciones.
Sostenibilidad UTEC
Informes de sostenibilidad
contacto:
Giancarlo Marcone
DIRECTOR DE HACS
gmarcone@utec.edu.pe
- Gobernanza ambiental
- Gestión ambiental
- Formación
- Eventos
- Investigación
- Proyección social
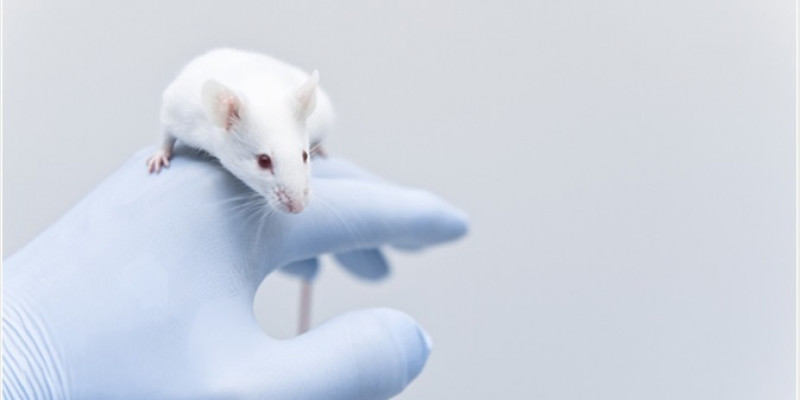
Desarrollo de ratones knockout
El desarrollo de animales knockout ha permitido avances importantes en la investigación biológica, los ratones knockout con deleciones de genes específicos o poblaciones celulares de interés han sido usados para estudiar e identificar componentes celulares y moleculares del sistema inmune, como el ratón TCR-B, que pierde a los linfocitos T, ratones μMT que pierden linfocitos B, ratones knock-out con deleciones para mediadores del sistema inmune como receptores del interferón I y II, convirtiéndose así en herramientas importantes para la modelación de desórdenes genéticos, para la asignación de diferentes funciones a los genes, para evaluar drogas y toxinas, etc.
¿Qué es un ratón transgénico?
Es un ratón que posee un gen que ha sido insertado en su genoma
¿Qué es un ratón knockout?
Es un ratón transgénico en el cual el gen insertado no se expresa o es un gen nulo
Desarrollo de ratones knockout
La infección de ratones pre-implantados (estadio de 4 a 8 células) con el virus de la leucemia murina Moloney (M-MuLV), generó ratones que desarrollaron leucemia inducida por M-MuLV, y el ADN viral se integró en la línea germinal de los ratones y se transmitió a su descendencia. Posteriormente, la microinyección directa del ADN de interés en el pronúcleo de embriones murinos fertilizados se desarrolló como la técnica más comúnmente utilizada para generar ratones transgénicos. Sin embargo la generación de ratones genéticamente modificados por infección de embriones con retrovirus o la microinyección de ADN en embriones murinos resulta en una integración al azar del ADN exógeno en el genoma del ratón, lo que puede llevar a una expresión variada del transgén y una interrupción inadvertida de los genes en el sitio en el que se inserta el transgén.
Las células embrionarias murinas (ESC) cuando se introducen en un embrión en etapa de preimplantación, contribuyen a la línea germinal; motivo por el cual las ESC se han usado ampliamente como vehículos para transferir modificaciones genéticas específicas del sitio de interés para la línea germinal del ratón. Las ESC derivan de la masa celular interna (ICM) pluripotente de los blastocistos, una estructura formada en la etapa temprana de la embriogénesis (embrión de ratón en etapa de preimplantación de 3.5 días), las ESC pueden formar a todos los tejidos embrionarios, incluidas las células germinales. Para que las ESC al ser cultivadas in vitro conserven su pluripotencialidad y viabilidad es necesario mantenerlas en un medio de cultivo en presencia de factores inhibidores de diferenciación. El medio de cultivo se basa en la presencia de fibroblastos primarios mitóticamente inactivados (tratados con mytomicina C o irradiados con rayos gamma) extraídos de tejido embrionario de ratones entre los días 13-14 de gestación, que sirven principalmente como matriz para favorecer la adherencia celular y para alimentar a las células madre. En cuanto a los factores suministrados por los fibroblastos se encuentran, el factor inhibidor de leucemia (LIF) que es una glicoproteína multifuncional que tiene múltiples efectos en diferentes órganos y sistemas y los ligandos de la vía de señalización de TGF-ß / BMP que influyen en el estado y la pluripotencia de las ESC murinas.
Usando las técnicas actuales, casi no hay limitaciones en los tipos de modificaciones que se pueden introducir, que van desde la inserción de genes, mutaciones puntuales, eliminaciones de corto y largo alcance, inversiones. Los knockouts condicionales o knockins se generan al colocar los sitios loxP o FRT que flanquean los exones seleccionados. La introducción de modificaciones específicas del sitio en el genoma de las ESC mediante recombinación homóloga, un proceso llamado selección de genes, se logra a través de la introducción de un vector de orientación en las ESC mediante electroporación
Un vector de direccionamiento (constructo de ADN) está compuesto típicamente de tres unidades básicas: (i) un brazo de homología 5 ', (ii) un marcador de gen seleccionable positivo (como el gen de resistencia a neomicina (neo) que codifica la enzima bacterial aminoglicósido-transferasa (APH), que se expresa en células mamíferas y que produce resistencia a los antibióticos aminoglicósidos, (iii) un brazo de homología 3 '. El vector de direccionamiento transfectado puede insertarse al azar en el genoma o integrarse mediante recombinación homóloga según lo determinen los brazos de homología 5 'y 3'. Las células transfectadas con éxito se seleccionan positivamente mediante el cultivo de ESC en medio con neomicina u otros antibióticos apropiados, como higromicina o puromicina.
Las células madre embrionarias transfectadas y exitosamente seleccionadas, son inyectadas en los embriones de ratón. Estos son posteriormente implantados en hembras pseudopreñadas; hembras hormonalmente preparadas para recibir e implantar un embrión después de ser cruzadas con ratones machos estériles.
Los ratones quiméricos (ratón que consiste en dos o más tipos celulares genéticamente diferentes y derivados de diferentes cigotos), en los cuales las células ES modificadas genéticamente inyectadas han contribuido a la formación de la mayoría o de todos los tejidos, nacerán en frecuencias que varían desde un pequeño porcentaje a la mayoría de las crías. Si las células ES modificadas genéticamente han contribuido a la formación de células germinales, las modificaciones genéticas introducidas pueden transmitirse a la descendencia de los ratones quiméricos. Para facilitar la selección de la descendencia quimérica deseada, las células ES y los blastocistos receptores se derivan de diferentes cepas de ratón con colores de pelaje distinguibles (cada cepa de ratón es homocigótica para el alelo del color de pelaje correspondiente). El esperma u óvulo presente en los ratones quiméricos, si provienen de las células introducidas en el blastocisto, portará los genes alterados. Cuando estos animales se cruzan con animales sanos, las crías resultantes heredarán una copia del cromosoma que lleva la mutación y que proviene de la célula madre embrionaria transfectada, así estos serán animales mutados heterocigotos. Posteriormente, es necesario que estos animales heterocigotos se crucen entre sí para obtener ratones que tengan dos copias del gen mutado (una de cada progenitor), es decir, animales homocigotos knock-out. Estos animales presentan una ausencia completa del gen normal.
Bibliografía
Bouabe, H., & Okkenhaug, K. (2013). Gene Targeting in Mice: A Review. In Methods in Molecular Biology (pp. 315–336).
Herrera, A. (2005) Principios básicos y simples de la tecnología transgénica y knock-out. CES Medicina. (pp.43-51).
CONOCE MÁS SOBRE BIOINGENIERIA EN UTEC ![]() Y VIVE LA INGENIERIA
Y VIVE LA INGENIERIA ![]() Bioingenieria
Bioingenieria ![]()
EN UTEC VENIMOS DESARROLLANDO LA TECNOLOGÍA
Y LA INGENIERÍA QUE NECESITA EL MUNDO DEL MAÑANA
Carreras en ingeniería y tecnología que van de la mano con la investigación y la creación de soluciones tecnológicas de vanguardia, comprometidas con las necesidades sociales y la sostenibilidad.
Decide convertirte en el profesional que el mundo necesita. Estudia en UTEC y lleva tu ingenio hacia el futuro.
Déjanos tus datos y suscríbete a nuestros boletines UTEC
Otras publicaciones
-
- Investigación
- Centros de Investigación
- Proyectos
- Investigadores
-
- Educación Ejecutiva
- Educación Ejecutiva
- Programas corporativos
- Conócenos