Conoce
Quiénes Somos
Nuestra Oferta
Académica
Ingenio
vocación y
aspiración
a la excelencia
- Administración y Negocios Digitales
- Ciencia de Datos
- Ciencia de la Computación
- Bioingeniería
- Ingeniería Ambiental
- Ingeniería Civil
- Ingeniería de la Energía
- Ingeniería Electrónica
- Ingeniería Industrial
- Ingeniería Mecánica
- Ingeniería Mecatrónica
- Ingeniería Química
- Sistemas de Información
- Blog de carreras
- Bienestar Estudiantil
- Repositorio Proyectos Interdisciplinarios
- Postula
Experiencia
en Investigación
- Dirección de Investigación
- Centro de Investigación y Tecnología del Agua
- Centro de Investigación en Bioingeniería
- Centro de Investigación y Conservación del Patrimonio
- Centro de Impacto y Responsabilidad Social
- Centro de Investigación del Cemento y Concreto
- Centro de Investigación en Computación Sostenible
- Investigadores
- Proyectos
- CRIS UTEC
Sostenibilidad UTEC
- Gobernanza ambiental
- Gestión ambiental
- Formación
- Eventos
- Investigación
- Proyección social
Conoce
Quiénes Somos
La universidad que potencia el ingenio, la innovación y el emprendimiento.
Nuestra Oferta
Académica
Nuestros estudiantes experimentan la ingeniería, la computación y los negocios desde el día uno a través de nuestra metodología de aprendizaje activo
Ingenio
vocación y
aspiración
a la excelencia
Ese es el ADN de nuestros estudiantes: alcanzar el más alto nivel académico y desarrollo personal.
Experiencia
en Investigación
El paso decisivo para encontrar las mejores soluciones.
Sostenibilidad UTEC
Informes de sostenibilidad
contacto:
Giancarlo Marcone
DIRECTOR DE HACS
gmarcone@utec.edu.pe
- Gobernanza ambiental
- Gestión ambiental
- Formación
- Eventos
- Investigación
- Proyección social
Conoce
Quiénes Somos
La universidad que potencia el ingenio, la innovación y el emprendimiento.
Nuestra Oferta
Académica
Nuestros estudiantes experimentan la ingeniería, la computación y los negocios desde el día uno a través de nuestra metodología de aprendizaje activo
Ingenio
vocación y
aspiración
a la excelencia
Ese es el ADN de nuestros estudiantes: alcanzar el más alto nivel académico y desarrollo personal.
Experiencia
en Investigación
El paso decisivo para encontrar las mejores soluciones.
Sostenibilidad UTEC
Informes de sostenibilidad
contacto:
Giancarlo Marcone
DIRECTOR DE HACS
gmarcone@utec.edu.pe
- Gobernanza ambiental
- Gestión ambiental
- Formación
- Eventos
- Investigación
- Proyección social
Usted está aquí
Bioimpresión 3D: imitando la estructura del miocardio
Autor:
Luz Pérez Túlich
Laboratorio de Ingeniería de Tejidos y Biología Sintética
Departamento de Bioingeniería
El miocardio es un tejido muy anisotrópico, con miocitos (eje largo aproximadamente 10 veces el eje transversal) organizados en haces paralelos. La organización de las miofibras es importante para la función cardíaca y la conducción del impulso eléctrico[1], siendo todo un reto para la ingeniería de tejidos los efectos de la alineación de los cardiomiocitos sobre el acoplamiento en la excitación-contracción, el acortamiento y el desarrollo de la fuerza.
En una distribución 3D es posible controlar la forma celular y la orientaciones mediante la ingeniería de microestructuras de andamios y encapsulando células, en un reciente paper[2], muestran un método novedoso de encapsulación celular en andamios 3D de gelatina metacrilada (GelMA) modelados a través de impresión óptica continua a microescala (μCOP) la cual puede crear un micropatrón rápido de cardiomiocitos ventriculares de ratón neonatal (NMVCM) en hidrogeles fotorreticulables. Los cardiomiocitos encapsulados se alinean preferentemente con la microarquitectura diseñada y pueden mostrar la morfología y la alineación fenotípica de las miofibrillas del miocardio in vivo.
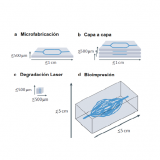
Pero ¿Qué es el sistema μCOP y cómo crearon el micropatrón de cardiomiocitos? Este sistema proyecta una imagen 2D en un volumen de solución de prepolímero, emparejando el movimiento de la etapa con cambios en las máscaras digitales, proporcionando una mayor resolución z, logrando imprimir estructuras 3D complejas en segundos a alta resolución (~ 1 μm) en múltiples órdenes de magnitud en escala [3]. Los patrones definidos por el usuario se cargan en el chip del dispositivo digital de microespejos (DMD), designando los espejos como "encendidos" o "apagados". Los espejos que están "encendidos" reflejan la luz ultravioleta, que posteriormente se enfoca mediante la óptica de proyección sobre la solución de prepolímero, iniciando inmediatamente la polimerización para producir una estructura 3D que replica el patrón designado, usando las biotintas apropiadas, las células pueden modelarse directamente en un hidrogel 3D, lo que permite el control sobre la alineación y concentración de células en la construcción de tejido impreso. [2]
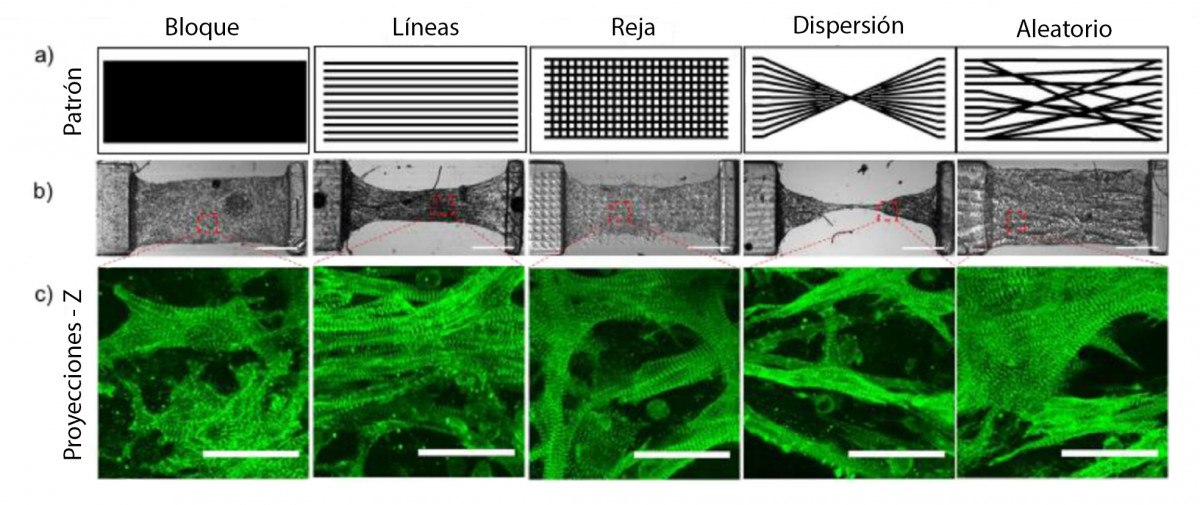
Figura 1. El micropatrón del tejido cardíaco afecta el desplazamiento. a) Máscaras de varios patrones complejos que incluyen (de izquierda a derecha) bloque, línea, reja, dispersión y diseños aleatorios. b) Imágenes de * DIC que muestran cada tejido con patrón en el día 10 (la barra de escala es de 500 μm). c) Imágenes fluorescentes de NMVCMS teñidas para α-actinina para cada tipo de andamio que muestran la alineación de los sarcómeros (la barra de escala es de 25 μm).
Fuente: J. Liu, et al. Biomaterials (2020).2
Utilizando µCOP, los autores diseñaron un sistema de medición de fuerza asimétrico y personalizable con patrón directo de cardiomiocitos encapsulados. Los cardiomiocitos ventriculares de ratón neonatal (NMVCM) se alinearon progresivamente con la microarquitectura diseñada y formaron un tejido que se contraía sincrónicamente con una fuerza determinada mediante la desviación de un medidor de fuerza integrado impreso en 3D. Encontrando que la impresión 3D directa de células en un patrón anisotrópico mejora la alineación del sarcómero y la producción de fuerza del tejido cardíaco, en comparación con las muestras sembradas en geometría coincidente.
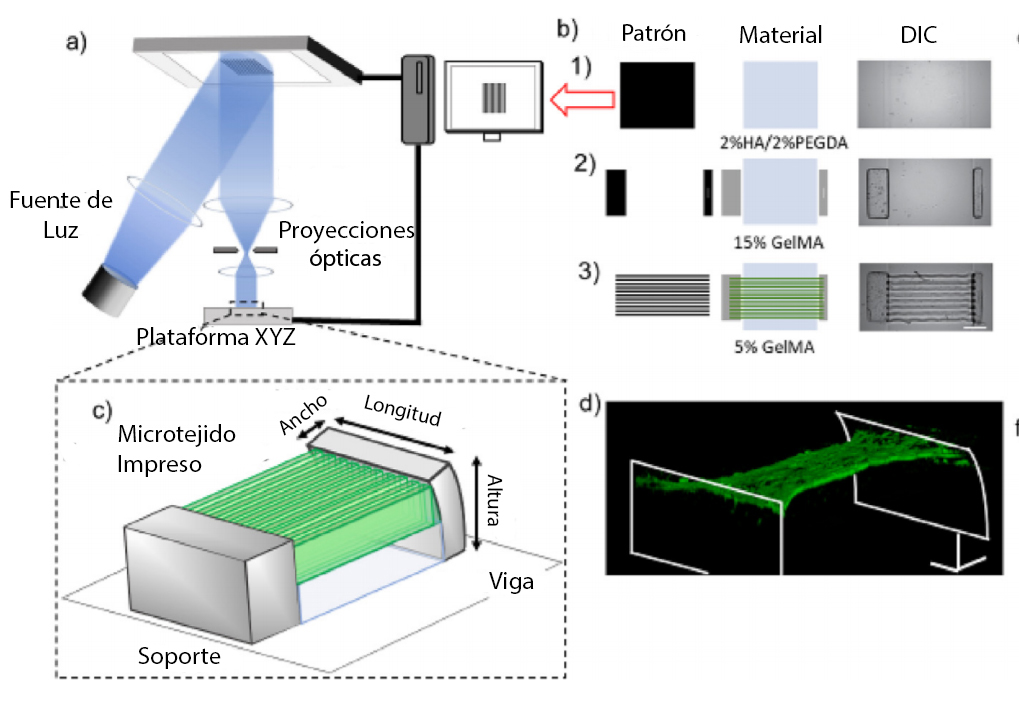
Figura 2. Impresión μCOP de un tejido cardíaco 3D. a) Esquema del sistema de impresión μCOP. b) Ajuste de la mascarilla y orden de impresión de: 1) 2% HAGM / 2% PEGDA, 2) 15% GelMA, 3) 5% GelMA / NMVCM con imágenes DIC (barra de escala 250 μm). c) Esquema 3D de un andamio completo de medición de tejidos en 3D. d) Reconfiguración confocal en 3D de tejido cardíaco NMVCM teñido para actina (rojo) y núcleos (azul) a través de pilares.
Fuente: J. Liu, et al. Biomaterials (2020).2
Video: Microtisidos cardíacos en 3D utilizando células encapsuladas en gelatina metacrilada e impresión óptica continua a microescala.
Fuente: Biomaterials (2020).4
* DIC:Correlación Digital de Imágenes.
Bibliografía:
1. Campanale CM, Scherrer B, Afacan O, Majeed A, Warfield SK, Sanders SP. Myofiber organization in the failing systemic right ventricle. Journal of Cardiovascular Magnetic Resonance. 2020. doi:10.1186/s12968-020-00637-9
2. Liu J, Miller K, Ma X, Dewan S, Lawrence N, Whang G, et al. Direct 3D bioprinting of cardiac micro-tissues mimicking native myocardium. Biomaterials. 2020. p. 120204. doi:10.1016/j.biomaterials.2020.120204
3. Wei Zhu, Jinxing Li, Yew J. Leong, et al. 3D Printed Artificial Micro- Fish Adv Mater. 2015 Aug; 27(30): 4411–4417. doi: 10.1002/adma.201501372
4. Video disponible en: https://www.facebook.com/watch/?v=335713944373242
EN UTEC VENIMOS DESARROLLANDO LA TECNOLOGÍA
Y LA INGENIERÍA QUE NECESITA EL MUNDO DEL MAÑANA
Carreras en ingeniería y tecnología que van de la mano con la investigación y la creación de soluciones tecnológicas de vanguardia, comprometidas con las necesidades sociales y la sostenibilidad.
Decide convertirte en el profesional que el mundo necesita. Estudia en UTEC y lleva tu ingenio hacia el futuro.
Déjanos tus datos y suscríbete a nuestros boletines UTEC
Otras publicaciones
-
- Investigación
- Centros de Investigación
- Proyectos
- Investigadores
-
- Educación Ejecutiva
- Educación Ejecutiva
- Programas corporativos
- Conócenos