Conoce
Quiénes Somos
Nuestra Oferta
Académica
Ingenio
vocación y
aspiración
a la excelencia
- Administración y Negocios Digitales
- Ciencia de Datos
- Ciencia de la Computación
- Bioingeniería
- Ingeniería Ambiental
- Ingeniería Civil
- Ingeniería de la Energía
- Ingeniería Electrónica
- Ingeniería Industrial
- Ingeniería Mecánica
- Ingeniería Mecatrónica
- Ingeniería Química
- Sistemas de Información
- Blog de carreras
- Bienestar Estudiantil
- Repositorio Proyectos Interdisciplinarios
- Postula
Experiencia
en Investigación
- Dirección de Investigación
- Centro de Investigación y Tecnología del Agua
- Centro de Investigación en Bioingeniería
- Centro de Investigación y Conservación del Patrimonio
- Centro de Impacto y Responsabilidad Social
- Centro de Investigación del Cemento y Concreto
- Centro de Investigación en Computación Sostenible
- Investigadores
- Proyectos
- CRIS UTEC
Sostenibilidad UTEC
- Gobernanza ambiental
- Gestión ambiental
- Formación
- Eventos
- Investigación
- Proyección social
Conoce
Quiénes Somos
La universidad que potencia el ingenio, la innovación y el emprendimiento.
Nuestra Oferta
Académica
Nuestros estudiantes experimentan la ingeniería, la computación y los negocios desde el día uno a través de nuestra metodología de aprendizaje activo
Ingenio
vocación y
aspiración
a la excelencia
Ese es el ADN de nuestros estudiantes: alcanzar el más alto nivel académico y desarrollo personal.
Experiencia
en Investigación
El paso decisivo para encontrar las mejores soluciones.
Sostenibilidad UTEC
Informes de sostenibilidad
contacto:
Giancarlo Marcone
DIRECTOR DE HACS
gmarcone@utec.edu.pe
- Gobernanza ambiental
- Gestión ambiental
- Formación
- Eventos
- Investigación
- Proyección social
Conoce
Quiénes Somos
La universidad que potencia el ingenio, la innovación y el emprendimiento.
Nuestra Oferta
Académica
Nuestros estudiantes experimentan la ingeniería, la computación y los negocios desde el día uno a través de nuestra metodología de aprendizaje activo
Ingenio
vocación y
aspiración
a la excelencia
Ese es el ADN de nuestros estudiantes: alcanzar el más alto nivel académico y desarrollo personal.
Experiencia
en Investigación
El paso decisivo para encontrar las mejores soluciones.
Sostenibilidad UTEC
Informes de sostenibilidad
contacto:
Giancarlo Marcone
DIRECTOR DE HACS
gmarcone@utec.edu.pe
- Gobernanza ambiental
- Gestión ambiental
- Formación
- Eventos
- Investigación
- Proyección social
Usted está aquí
El Virus de Inmunodeficiencia humana sigue siendo una amenaza para la salud humana mundial. A pesar de terapias prometedoras como antirretroviral (cART) e incluso las terapias de reemplazo de médula ósea, se controla la replicación del VIH-1, pero ninguna terapia actual afecta al genoma viral latente insertado en las células humanas.
El virus VIH es actualmente tratado por terapia de antirretrovirales que afecta la replicación viral controlando la enfermedad. A pesar de que estos fármacos son muy efectivos, se debe considerar su costo y el hecho de que las personas deben tomarlos de manera crónica. Por ello, muchas personas preferirían eliminar completamente el virus de su genoma, incluso aquellos reservorios virales latentes [1]. La mutación delta 32 causa una alteración en el receptor de quimiocinas CCR5. Dicho receptor sirve para el ingreso del virus de inmunodeficiencia adquirida (VIH) a las células T CD4 del sistema inmunológico. Las personas con esta rara mutación no se infectan con VIH-1 y no desarrollan el síndrome SIDA [2].
Figura 1. El Virus de Inmunodeficiencia adquirida es un patógeno de preocupación mundial. La herramienta molecular CRISPR es un método promisorio que podría remover el genoma “reservorio” del VIH-1 en pacientes infectados.
Muchos intentos han tratado de expandir esta condición en personas que se encuentran infectadas con VIH-1 a manera de una terapia genética. El objetivo es reducir la carga viral a menos de 200 copias por mililitro de sangre, lo que permite que el sistema inmunológico se haga cargo del virus y las personas no son capaces de transmitir al virus por vía sexual. En 2014, Tebas y colaboradores, inyectaron a 12 pacientes con células T CD4 expresando una proteína llamada “Zinc Finger” o “dedo de zinc” fusionada a una nucleasa de ADN.
Este “caballo de troya” se conoce como ZFN (“zinc finger nuclease”) consiste en inyectar 10 mil millones de células T CD4 recombinantes, intravenosamente en pacientes VIH positivo; a los cuales se les suspendió la terapia antirretroviral. Los dedos de zinc o ZFN reconocen una región en el genoma viral y la eliminan. Empleando ZFN, se produjo un efecto adverso grave producto de la transfusión y solo en el 25% de los pacientes el VIH-1 era indetectable [3].
En 2019, se realizó un trasplante de médula ósea para un paciente con leucemia linfoblástica aguda y a la vez VIH positivo. Se utilizaron células madre y progenitoras hematopoyéticas (HSPC) editadas con CRISPR deficientes en CCR5. No se observaron efectos adversos de las células HSPC (CCR5-/CRISPR) y se logró un establecimiento de estas a largo plazo. Sin embargo, solo el 5 % de los linfocitos poseen una interrupción de CCR5 [4].
Se han reportado casos en donde el tratamiento de médula ósea convencional empleando un donante con la mutación CCR5 pueden evitar la infección por VIH. En dichos casos, las personas se han declarado libres de VIH por dicha terapia. Recientemente, en el congreso CROI 2022; se reportó un tratamiento nuevo y exitoso en una mujer con remisión de VIH. La persona VIH positiva había desarrollado leucemia mieloide aguda. Ambas enfermedades fueron tratadas con antirretrovirales y quimioterapia, respectivamente. En 2017, se sometió a un tratamiento en donde células madre de cordón umbilical de un donante con la mutación CCR5 y células madre de un donante de médula ósea. Luego de 37 meses del trasplante dual, se suspendió la terapia antirretroviral y actualmente el VIH es indetectable en el suero [5].
El trasplante de médula ósea es un procedimiento costoso, de alto riesgo y existen muy pocos donantes de médula disponibles con la mutación delta 32. Adicionalmente, requieren meses de búsqueda de donantes y preparación del paciente y métodos de laboratorio caso por caso. ¿Se podría implementar una estrategia de terapia generalizada para poder eliminar el VIH en pacientes en terapia antirretroviral a un costo razonable?
La principal limitante de las terapias es que el virus puede permanecer inactivo por años sin producir copias, pero con una carga viral infecciosa. Los reservorios de VIH en el genoma son inalcanzables para el sistema inmunológico y las terapias actuales. El sistema de edición genética CRISPR promete inactivar el genoma viral del VIH-1 en pacientes con terapia antirretroviral activa. Dicha afirmación es debido a los avances recientes con terapia CRISPR in vivo. Existen ejemplos exitosos de terapia “ex vivo” en donde se modifican genéticamente células del cuerpo extraídas del paciente, y posteriormente reintroducidas. Este procedimiento es costoso y especializado; además, no todos los padecimientos califican para terapia de aislamiento celular “ex vivo”.
El siguiente reto para el sistema CRISPR es la entrega “in vivo” de la maquinaria de edición genética. En esta configuración la edición genética ocurre dentro del cuerpo del paciente. La amiloidosis de transtiretina (ATTR) se caracteriza por la acumulación de esta proteína mal plegada en tejidos del sistema nervioso y corazón. El sistema CRISPR NTLA-2001 consiste en nanopartícula lipídicas (LNP) que son transportadas al hígado por transfusión sanguínea. Los hepatocitos absorben LNP/CRISPR, e inicia el proceso de edición genética. Del mismo modo, se procede en el tratamiento de la enfermedad de angioedema hereditario, en donde el gen KLKB1 que codifica para la proteína calicreína debe ser inactivado. La sobreacumulación de esta proteína produce bradiquinina causante de severas inflamaciones que pueden llegar a ser mortales. La empresa Intellia Therapeutics emplea esta estrategia debido a que el hígado fácilmente absorbe las micelas de grasa (LNP) y es relativamente simple tratar padecimientos relacionados al correcto funcionamiento de este órgano. Empleando este método, reportan que el sistema CRISPR redujo la proteína dañina (transtiretina); en más del 90 por ciento de un total de 12 personas con amiloidosis, una enfermedad genética que puede provocar insuficiencia cardíaca [6].
Actualmente, el reto para la terapia CRISPR es llevar la edición genética a otros órganos. La tecnología LNP no sirve para entregar CRISPR a órganos como el cerebro y los pulmones. Los investigadores ahora se preguntan si se podría detener a un patógeno como el VIH-1 y atacar al genoma insertado en los reservorios de linfocitos T CD4. El virus insertado necesita su genoma completo para replicarse. Por lo tanto, si CRISPR remueve fragmentos del mismo, inactivaría la capacidad del virus para infectar.
Los primeros estudios han resultado promisorios. Ratones de laboratorio modificados con inserciones del genoma del VIH-1, mostraron que CRISPR puede eliminar regiones del virus insertado en el ADN del huésped. El mismo grupo de investigadores demostró un efecto similar en simios, cuando se utiliza la herramienta para editar el genoma del virus SIV (“simian immunodeficiency virus”). La remoción del gen Gag en el ADN viral en ambos modelos animales hace que el virus sea indetectable en la sangre. En esta investigación publicada en la revista Nature en 2019, se demuestra que el virus puede eliminarse permanentemente del hospedero animal [7, 8].
Los antecedentes anteriores motivaron a los científicos a implementar los ensayos en pacientes seropositivos con tratamiento antirretroviral activo. La empresa Excision Biotherapeutics realiza el estudio en nueve pacientes en los que se realiza la entrega de CRISPR in vivo empleando adenovirus modificados para introducir la maquinaria de edición a los linfocitos T CD4 (Figura 2). Un sistema de este tipo debe tener las siguientes características: A) No causar efectos secundarios en las personas. B) El sistema no debe editar regiones fuera de contexto, es decir alterar el genoma humano y solo editar el genoma del VIH. C) Se elige una región viral que es conservada de modo que se garantice poca variación del ADN viral y una alta tasa de edición. D) Las células T CD4 editadas deben permanecer en esa condición en el tiempo. La edición genética debe ser estable. E) Es deseable que el sistema CRISPR se comporte de la misma manera en todas las personas.
Las personas en el estudio recibirán la transfusión de la terapia genética y dejarán de consumir los antirretrovirales. Se medirá la carga viral y el recuento de linfocitos T CD4 pre y posterior a la transfusión. El objetivo principal es lograr editar la mayor cantidad de linfocitos para lograr obtener menos de 200 copias de virus por mililitro, lo que convierte al paciente en seronegativo y es incapaz de transmitir el virus sexualmente [9].
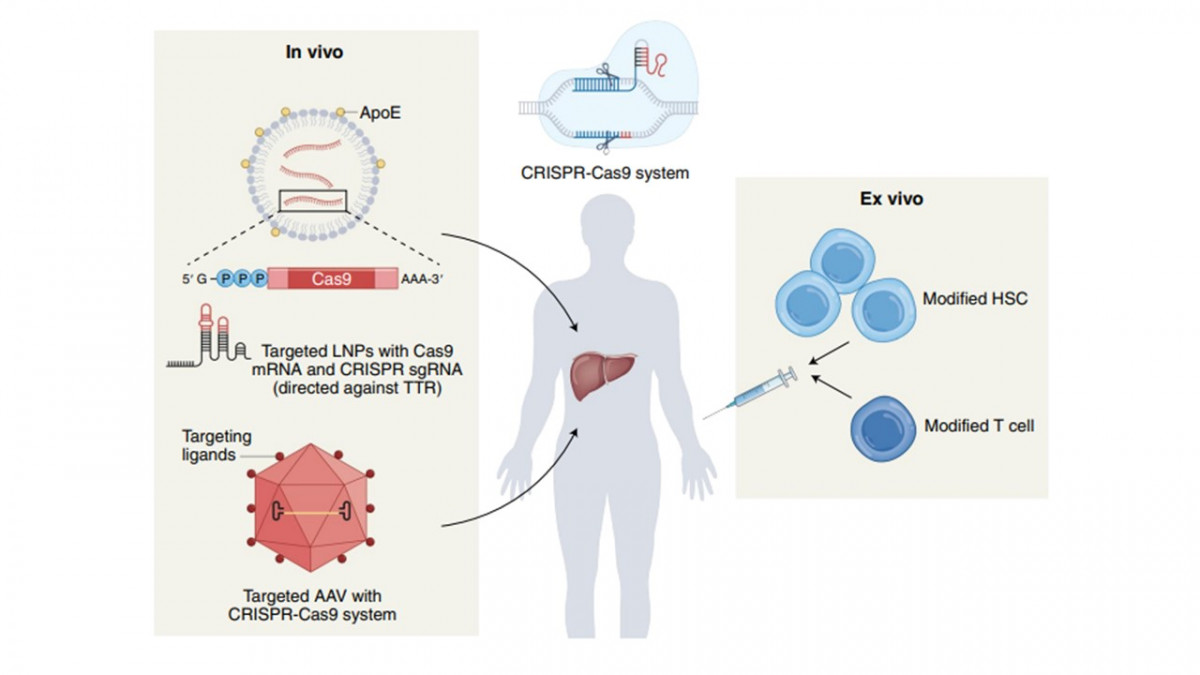
Figura 2. El sistema CRISPR se puede entregar a las células humanas en el formato ex vivo e in vivo. En el primer caso necesita un virus para ingresar a las células destino o se pueden emplear nanopartículas lipídicas (LNPs). En el segundo caso, se extraen células las cuales se modifican para expresar el sistema CRISPR y se reinsertan en el paciente. Imagen de Büning, H., Schambach; 2021, Nature Medicine 27, [9].
Aún existe muy poca información acerca del uso de esta terapia en seres humanos. Mas aún, la información del comportamiento del sistema CRISPR en un formato in vivo es una tecnología en desarrollo. Si se logra inactivar el genoma proviral latente en suficientes T CD4, el sistema inmunológico debería ser capaz de controlar la infección viral sin desarrollar SIDA. Al menos esa es la hipótesis actual de los científicos. Existen muchas interrogantes acerca del funcionamiento del sistema y aún hay pocas alternativas de entrega del sistema de edición genética a las células blanco in vivo. Sin embargo, el sistema CRISPR ya ha demostrado resultados prometedores en el caso de enfermedades genéticas. ¿Se lograrán resultados similares para controlar una infección viral como la de VIH-1?
Referencias bibliográficas
1.- Zhihao Zhang, Wei Hou, Shuliang Chen, Updates on CRISPR-based gene editing in HIV-1/AIDS therapy. 2022. Virologica Sinica, Volume 37, Issue 1, 2022, Pages 1-10, ISSN 1995-820X, https://doi.org/10.1016/j.virs.2022.01.017.
2.- Samson, M., Libert, F., Doranz, B. et al. Resistance to HIV-1 infection in Caucasian individuals bearing mutant alleles of the CCR-5 chemokine receptor gene. Nature 382, 722–725 (1996). https://doi.org/10.1038/382722a0
3.- Tebas, Pablo and Stein, David and Tang, Winson W. and Frank, Ian and Wang, Shelley Q. and Lee, Gary and Spratt, S. Kaye and Surosky, Richard T. and Giedlin, Martin A. and Nichol, Geoff and Holmes, Michael C. and Gregory, Philip D. and Ando, Dale G. and Kalos, Michael and Collman, Ronald G. and Binder-Scholl, Gwendolyn and Plesa, Gabriela and Hwang, Wei-Ting and Levine, Bruce L. and June, Carl H. Gene Editing of CCR5 in Autologous CD4 T Cells of Persons Infected with HIV. 2014. New England Journal of Medicine, vol 370, number 10, pp 901-910. https://doi.org/10.1056/NEJMoa1300662
4.- Xu Lei, Wang Jun, Liu Yulin, Xie Liangfu, Su Bin, Mou Danlei, Wang Longteng, Liu Tingting, Wang Xiaobao, Zhang Bin, Zhao Long, Hu Liangding, Ning Hongmei, Zhang Yufeng, Deng Kai, Liu Lifeng, Lu Xiaofan, Zhang Tong, Xu Jun, Li Cheng, Wu Hao, Deng Hongkui, Chen Hu. 2019. CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia. New England Journal of Medicine; vol 381, number 13, pp 1240-1247. https://doi.org/10.1056/NEJMoa1817426
5.- First case of HIV cure in a woman after stem cell transplantation reported at CROI-2022. World Health Organization Report 2022. https://www.who.int/news/item/24-03-2022-first-case-of-hiv-cure-in-a-wom...
6.- Gillmore Julian D., Gane Ed, Taubel Jorg, Kao Justin, Fontana Marianna, Maitland Michael L., Seitzer Jessica, O’Connell Daniel, Walsh Kathryn R., Wood Kristy, Phillips Jonathan, Xu Yuanxin, Amaral Adam, Boyd Adam P., Cehelsky Jeffrey E., McKee Mark D., Schiermeier Andrew, Harari Olivier, Murphy Andrew, Kyratsous Christos A., Zambrowicz Brian, Soltys Randy, Gutstein David E., Leonard John, Sepp-Lorenzino Laura, Lebwohl, David. 2021. New England Journal of Medicine, vol 385, No. 6, pp 493-502. https://doi.org/10.1056/NEJMoa2107454
7.- Dash, P.K., Kaminski, R., Bella, R. et al. Sequential LASER ART and CRISPR Treatments Eliminate HIV-1 in a Subset of Infected Humanized Mice. Nat Commun 10, 2753 (2019). https://doi.org/10.1038/s41467-019-10366-y
8.- Mancuso, P., Chen, C., Kaminski, R. et al. CRISPR based editing of SIV proviral DNA in ART treated non-human primates. Nat Commun 11, 6065 (2020). https://doi.org/10.1038/s41467-020-19821-7
9.- Büning, H., Schambach, A. A first step toward in vivo gene editing in patients. Nat Med 27, 1515–1517 (2021). https://doi.org/10.1038/s41591-021-01476-6
EN UTEC VENIMOS DESARROLLANDO LA TECNOLOGÍA
Y LA INGENIERÍA QUE NECESITA EL MUNDO DEL MAÑANA
Carreras en ingeniería y tecnología que van de la mano con la investigación y la creación de soluciones tecnológicas de vanguardia, comprometidas con las necesidades sociales y la sostenibilidad.
Decide convertirte en el profesional que el mundo necesita. Estudia en UTEC y lleva tu ingenio hacia el futuro.
Déjanos tus datos y suscríbete a nuestros boletines UTEC
Otras publicaciones
-
- Investigación
- Centros de Investigación
- Proyectos
- Investigadores
-
- Educación Ejecutiva
- Educación Ejecutiva
- Programas corporativos
- Conócenos