Conoce
Quiénes Somos
Nuestra Oferta
Académica
Ingenio
vocación y
aspiración
a la excelencia
- Administración y Negocios Digitales
- Ciencia de Datos
- Ciencia de la Computación
- Bioingeniería
- Ingeniería Ambiental
- Ingeniería Civil
- Ingeniería de la Energía
- Ingeniería Electrónica
- Ingeniería Industrial
- Ingeniería Mecánica
- Ingeniería Mecatrónica
- Ingeniería Química
- Sistemas de Información
- Blog de carreras
- Bienestar Estudiantil
- Repositorio Proyectos Interdisciplinarios
- Postula
Experiencia
en Investigación
- Dirección de Investigación
- Centro de Investigación y Tecnología del Agua
- Centro de Investigación en Bioingeniería
- Centro de Investigación y Conservación del Patrimonio
- Centro de Impacto y Responsabilidad Social
- Centro de Investigación del Cemento y Concreto
- Centro de Investigación en Computación Sostenible
- Investigadores
- Proyectos
- CRIS UTEC
Sostenibilidad UTEC
- Gobernanza ambiental
- Gestión ambiental
- Formación
- Eventos
- Investigación
- Proyección social
Conoce
Quiénes Somos
La universidad que potencia el ingenio, la innovación y el emprendimiento.
Nuestra Oferta
Académica
Nuestros estudiantes experimentan la ingeniería, la computación y los negocios desde el día uno a través de nuestra metodología de aprendizaje activo
Ingenio
vocación y
aspiración
a la excelencia
Ese es el ADN de nuestros estudiantes: alcanzar el más alto nivel académico y desarrollo personal.
Experiencia
en Investigación
El paso decisivo para encontrar las mejores soluciones.
Sostenibilidad UTEC
Informes de sostenibilidad
contacto:
Giancarlo Marcone
DIRECTOR DE HACS
gmarcone@utec.edu.pe
- Gobernanza ambiental
- Gestión ambiental
- Formación
- Eventos
- Investigación
- Proyección social
Conoce
Quiénes Somos
La universidad que potencia el ingenio, la innovación y el emprendimiento.
Nuestra Oferta
Académica
Nuestros estudiantes experimentan la ingeniería, la computación y los negocios desde el día uno a través de nuestra metodología de aprendizaje activo
Ingenio
vocación y
aspiración
a la excelencia
Ese es el ADN de nuestros estudiantes: alcanzar el más alto nivel académico y desarrollo personal.
Experiencia
en Investigación
El paso decisivo para encontrar las mejores soluciones.
Sostenibilidad UTEC
Informes de sostenibilidad
contacto:
Giancarlo Marcone
DIRECTOR DE HACS
gmarcone@utec.edu.pe
- Gobernanza ambiental
- Gestión ambiental
- Formación
- Eventos
- Investigación
- Proyección social
Usted está aquí
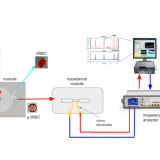
Ensayo clínico histórico: Edición genética en humanos mediante las tijeras moleculares CRISPR
Autor:
Prof. Alberto Donayre
Departamento de Bioingeniería
Las “tijeras” moleculares con los cortes más precisos en la naturaleza, pertenecen a la familia CRISPR (“clustered regularly interspaced short palindromic repeats”). Recientemente, las científicas Emmanuelle Charpentier y Jennifer Doudna recibieron el máximo galardón a la investigación científica obteniendo el premio nobel de química. Este último gracias al estudio del funcionamiento de las tijeras moleculares enzimáticas que permiten editar el genoma de los organismos vivos, iniciando una amplia gama de posibilidades para la terapia de reparación de material genético [1].

Imagen 1. Jennifer Doudna y Emmanuelle Charpentier, Nobel de química 2020.
Fuente: Nature,2020.
El mecanismo radica en el reconocimiento de una región del ADN genómico, mediante una molécula de ARN expresada constitutivamente llamada ARN guía (gRNA). Este elemento permite que la enzima nucleasa Cas9 pueda reconocer una región específica en el genoma y realice cortes en ambas cadenas del ADN. El reconocimiento por el gRNA es tan corto como de 20 nucleótidos, suficientes para que se discrimine regiones muy específicas en la basta diversidad del genoma. Estos cortes se producen empleando dos dominios de nucleasa en la enzima Cas9, RuvC y HNH que causan la deleción o inserción de nucleótidos en el ADN. Estos cortes constantes sobrepasan al sistema de reparación de ADN de las células, el que termina alterando la región removiendo o añadiendo nucleótidos, ocasionando un cambio genómico [2]. Es un sistema mucho más rápido, económico y eficaz para edición de genomas que los anteriormente reportados [3].
Las tres empresas con mayor avance tecnológico en terapia genómica: Intellia Therapeutics, Editas Medicine y CRISPR Therapeutics; se encuentran desarrollando metodologías para reparar el ADN en humanos. Cuando algún gen posee una mutación que se asocia a alguna enfermedad hereditaria, las tijeras moleculares CRISPR se encargan de reparar el ADN. La reparación puede consistir en reemplazar el gen defectuoso. Algunos ejemplos de este tipo son: Amaurosis congénita de Leber, Síndrome de Usher, Beta-Talasemia, Anemia falciforme, Retinitis Pigmentosa y algunos otros padecimientos neurológicos. La empresa Intellia Therapeutics anunció el 9 de noviembre del 2020, que el primer paciente fue tratado empleando esta tecnología. El producto terapéutico llamado “NTLA-2001” es un compuesto enzimático diseñado para revertir la Amiloidosis cardiaca [4]. En el estudio en fase 1, se evaluará la intensidad de dosis en pacientes con este padecimiento. De hecho, esta misma empresa recibió este año, un financiamiento de la fundación Bill & Melinda Gates para desarrollar estudios en terapia genética para la anemia falciforme. La importancia de esta nueva metodología radica en que reemplaza a métodos anteriores, que involucraban el empleo de vectores virales replicativos los cuales causan un potencial efecto nocivo y respuesta adversa en el sistema inmunológico del receptor. En este caso 38 personas recibirán la dosis intravenosa con la enzima CRISPR/Cas9 y los ARN guías específicos para el gen defectuoso [4].
Una de las mayores preocupaciones de este tipo de terapia es el fenotipo celular que será producido luego de la edición. Esto debido a que se depende de una alteración natural del gen blanco, causada por el mecanismo endógeno de reparación celular; por lo tanto, cada edición no constituye un evento idéntico. La segunda preocupación es acerca del reconocimiento inespecífico o “off-target”. Si bien es cierto, la secuencia de reconocimiento de 20 nucleótidos permite una alta especificidad; en modelos de animales y plantas se ha reportado edición fuera de contexto en limitados eventos. De modo que, se requiere que cada ARN guía empleado sea estudiado exhaustivamente a nivel computacional, en ensayos in vitro y finalmente in vivo para determinar si se podría producir un evento de edición inesperado fuera de contexto.
Considerando lo anterior, la terapia cercana más promisoria es la edición ex-vivo; en donde se extraen las células del paciente, se realiza la edición genómica y se reinsertan. Del mismo modo, se puede producir un banco de células universales disponibles para introducirlas en cualquier paciente. Estos métodos se están empleando en el tratamiento experimental de algunos tipos de cáncer (“CRISPR/CarT cells”)[5] y enfermedades hematológicas como beta-talasemia y anemia falciforme. En estas últimas enfermedades se realiza la edición del locus de la beta-globina fetal para incrementar sus niveles [6]. En poco tiempo veremos los primeros resultados de estas terapias.
Bibliografía:
1.- Heidi Ledford & Ewen Callaway; 2020. Pioneers of revolutionary CRISPR gene editing win chemistry Nobel. Nature 586, 346-347 (2020). doi: https://doi.org/10.1038/d41586-020-02765-9
2.- Martin Jinek, Krzysztof Chylinski, Ines Fonfara, Michael Hauer, Jennifer A. Doudna, Emmanuelle Charpentier. 2012. A Programmable Dual-RNA–Guided DNA Endonuclease in Adaptive Bacterial Immunity; Science, 17 Aug 2012: Vol. 337, Issue 6096, pp. 816-821. DOI: 10.1126/science.1225829
3.- Guha, T. K., Wai, A., & Hausner, G. (2017). Programmable Genome Editing Tools and their Regulation for Efficient Genome Engineering. Computational and structural biotechnology journal, 15, 146–160. https://doi.org/10.1016/j.csbj.2016.12.006
5.- Roth, T.L., Puig-Saus, C., Yu, R. et al. Reprogramming human T cell function and specificity with non-viral genome targeting. Nature 559, 405–409 (2018). https://doi.org/10.1038/s41586-018-0326-5
6.- Wu Y, Zeng J, Roscoe BP, Liu P, Yao Q, Lazzarotto CR, Clement K, Cole MA, Luk K, Baricordi C, Shen AH, Ren C, Esrick EB, Manis JP, Dorfman DM, Williams DA, Biffi A, Brugnara C, Biasco L, Brendel C, Pinello L, Tsai SQ, Wolfe SA, Bauer DE. Highly efficient therapeutic gene editing of human hematopoietic stem cells. Nat Med. 2019 May;25(5):776-783. https://doi.org/10.1038/s41591-019-0401-y
EN UTEC VENIMOS DESARROLLANDO LA TECNOLOGÍA
Y LA INGENIERÍA QUE NECESITA EL MUNDO DEL MAÑANA
Carreras en ingeniería y tecnología que van de la mano con la investigación y la creación de soluciones tecnológicas de vanguardia, comprometidas con las necesidades sociales y la sostenibilidad.
Decide convertirte en el profesional que el mundo necesita. Estudia en UTEC y lleva tu ingenio hacia el futuro.
Déjanos tus datos y suscríbete a nuestros boletines UTEC
Otras publicaciones
-
- Investigación
- Centros de Investigación
- Proyectos
- Investigadores
-
- Educación Ejecutiva
- Educación Ejecutiva
- Programas corporativos
- Conócenos