Conoce
Quiénes Somos
Nuestra Oferta
Académica
Ingenio
vocación y
aspiración
a la excelencia
- Administración y Negocios Digitales
- Ciencia de Datos
- Ciencia de la Computación
- Bioingeniería
- Ingeniería Ambiental
- Ingeniería Civil
- Ingeniería de la Energía
- Ingeniería Electrónica
- Ingeniería Industrial
- Ingeniería Mecánica
- Ingeniería Mecatrónica
- Ingeniería Química
- Sistemas de Información
- Blog de carreras
- Bienestar Estudiantil
- Repositorio Proyectos Interdisciplinarios
- Postula
Experiencia
en Investigación
- Dirección de Investigación
- Centro de Investigación y Tecnología del Agua
- Centro de Investigación en Bioingeniería
- Centro de Investigación y Conservación del Patrimonio
- Centro de Impacto y Responsabilidad Social
- Centro de Investigación del Cemento y Concreto
- Centro de Investigación en Computación Sostenible
- Investigadores
- Proyectos
- CRIS UTEC
Sostenibilidad UTEC
- Gobernanza ambiental
- Gestión ambiental
- Formación
- Eventos
- Investigación
- Proyección social
Conoce
Quiénes Somos
La universidad que potencia el ingenio, la innovación y el emprendimiento.
Nuestra Oferta
Académica
Nuestros estudiantes experimentan la ingeniería, la computación y los negocios desde el día uno a través de nuestra metodología de aprendizaje activo
Ingenio
vocación y
aspiración
a la excelencia
Ese es el ADN de nuestros estudiantes: alcanzar el más alto nivel académico y desarrollo personal.
Experiencia
en Investigación
El paso decisivo para encontrar las mejores soluciones.
Sostenibilidad UTEC
Informes de sostenibilidad
contacto:
Giancarlo Marcone
DIRECTOR DE HACS
gmarcone@utec.edu.pe
- Gobernanza ambiental
- Gestión ambiental
- Formación
- Eventos
- Investigación
- Proyección social
Conoce
Quiénes Somos
La universidad que potencia el ingenio, la innovación y el emprendimiento.
Nuestra Oferta
Académica
Nuestros estudiantes experimentan la ingeniería, la computación y los negocios desde el día uno a través de nuestra metodología de aprendizaje activo
Ingenio
vocación y
aspiración
a la excelencia
Ese es el ADN de nuestros estudiantes: alcanzar el más alto nivel académico y desarrollo personal.
Experiencia
en Investigación
El paso decisivo para encontrar las mejores soluciones.
Sostenibilidad UTEC
Informes de sostenibilidad
contacto:
Giancarlo Marcone
DIRECTOR DE HACS
gmarcone@utec.edu.pe
- Gobernanza ambiental
- Gestión ambiental
- Formación
- Eventos
- Investigación
- Proyección social
Usted está aquí
El cáncer de mama (CM) es la neoplasia maligna más común en mujeres a nivel mundial. Por lo que, se requieren modelos que representen el microambiente del tejido mamario para comprender mejor la tumorogénesis y la progresión del cáncer. El tratamiento sigue siendo uno de los más importantes problemas para los sistemas de salud; a pesar de las numerosas mejoras en el diagnóstico y la terapia, debido a la heterogeneidad que presenta, por lo que es importante encontrar métodos más eficaces para su estudio.
Previamente, los modelos de xenoinjertos derivados de líneas celulares y los cultivos celulares bidimensionales (2D) se emplearon con frecuencia para investigar el cáncer de mama. A pesar de su valor, estos modelos no son apropiados para investigar la biología tumoral y la reacción a fármacos de pacientes individuales y los cultivos celulares cultivados en 2D experimentan vías de señalización celular alteradas como resultado de la limitación de las interacciones célula-célula y célula-matriz extracelular (MEC); por lo que, no son representativos del tejido equivalente in vivo. La morfología y la organización de las células dentro de los tejidos, no pueden ser imitadas por células cultivadas en condiciones de monocapa 2D, y la ECM no coincide exactamente con la de los tejidos y órganos.
Numerosos tipos de células distintas, factores paracrinos y de crecimiento, así como elementos estructurales, están presentes en el microambiente tumoral. El resultado del tumor está determinado por cómo todas estas variables interactúan con las células tumorales. Investigaciones recientes apuntan a la implicación de la TME en el desarrollo del cáncer y su comportamiento en respuesta a diferentes terapias
Los estudios publicados sugieren que los cambios graduales en la composición genética y transcriptómica de las líneas celulares de cáncer de mama pueden afectar la forma en que estas, reaccionan a los medicamentos. Como ejemplo, tenemos a la línea celular MCF-7, que se utiliza con frecuencia en la investigación del cáncer de mama, se ha mostrado tasas de crecimiento, cariotipos, respuestas farmacológicas y estado del receptor hormonal variables en varios laboratorios. Por lo que se puede concluir que los organoides, que tienen un microambiente más parecido a las muestras de tumores; son preferibles a las líneas celulares universales para el estudio del cáncer de mama.
Los organoides son un modelo de estudio biomédico, que posee una amplia gama de usos, los cuales incluyen; oncología, medicina regenerativa, modelado de enfermedades y screening de fármacos; dado que se puede hacerlos crecer in vitro para crear copias en miniatura de los órganos de los que se derivaron.
Para su óptimo desarrollo, los organoides son incorporados a matrices que contienen proteínas de la membrana extracelular esenciales para la función y la polarización de las células epiteliales. Esta matriz permite que las células se organicen en estructuras 3D in vitro. Las matrices contienen terminaciones RGD (Arg-Gly-Asp) en su estructura que funcionan como puntos de unión para las células, permitiendo así el transporte adecuado de nutrientes y otros elementos esenciales para las células. En la actualidad en el mercado existen matrices tanto naturales como sintéticas; dentro de las matrices naturales tenemos al colágeno tipo I y al matrigel, este último es rico en laminina, colágeno IV, entactin, heparan sulfatos, proteoglicanos y factores de crecimiento.
Para comprender la biología del cáncer, los organoides son un instrumento útil. Sin embargo, algunos modelos de organoides mamarios están limitados porque no han podido recrear con precisión la estructura o composición de la MEC a partir de tejido mamario natural. Es importante tener en cuenta que muchos protocolos actuales implican varios pasos de centrifugación diferencial y filtración celular para separar y purificar las células epiteliales mamarias de las células estromales circundantes antes del crecimiento en cultivo 3D. El uso de células epiteliales purificadas y células del estroma para producir organoides mamarios puede no recapitular la arquitectura tisular in vivo y las interacciones célula-célula/matriz.
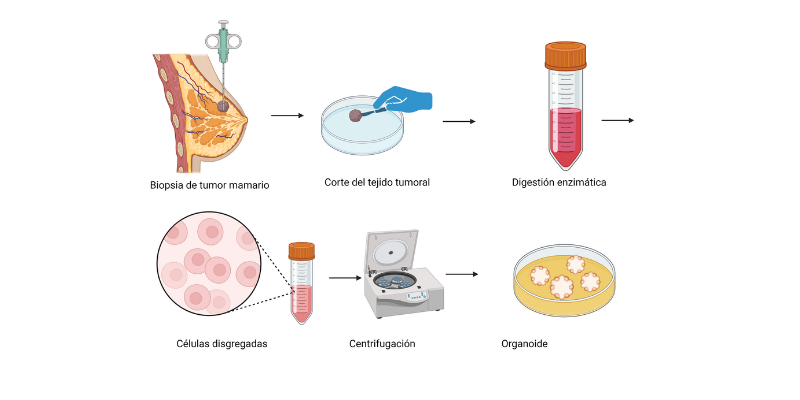
Imagen: Pasos básicos para la producción de organoides:
1)Corte del tejido, 2) Digestión enzimática 3) Separación celular 4)Suspensión en Matrigel u otra matriz y aplicación de medio de crecimiento.
Bibliografía
Mohan, S. C., Lee, T. Y., Giuliano, A. E., & Cui, X. (2021). Current Status of Breast Organoid Models. Frontiers in Bioengineering and Biotechnology, 9(November), 1–7. https://doi.org/10.3389/fbioe.2021.745943
Ebrahimi, N., Nasr Esfahani, A., Samizade, S., Mansouri, A., Ghanaatian, M., Adelian, S., Shadman Manesh, V., & Hamblin, M. R. (2022). The potential application of organoids in breast cancer research and treatment. Human Genetics, 141(2), 193–208. https://doi.org/10.1007/s00439-021-02390-0
EN UTEC VENIMOS DESARROLLANDO LA TECNOLOGÍA
Y LA INGENIERÍA QUE NECESITA EL MUNDO DEL MAÑANA
Carreras en ingeniería y tecnología que van de la mano con la investigación y la creación de soluciones tecnológicas de vanguardia, comprometidas con las necesidades sociales y la sostenibilidad.
Decide convertirte en el profesional que el mundo necesita. Estudia en UTEC y lleva tu ingenio hacia el futuro.
Déjanos tus datos y suscríbete a nuestros boletines UTEC
Otras publicaciones
-
- Investigación
- Centros de Investigación
- Proyectos
- Investigadores
-
- Educación Ejecutiva
- Educación Ejecutiva
- Programas corporativos
- Conócenos