Learn
About Us
The university that empowers ingenuity, innovation, and entrepreneurship.
Our Academic
Offer
With our active learning methodology, our students experience engineering from day one.
Ingenuity,
dedication, and
the pursuit
of excellence
Our students' DNA: achieving highest academic achievement and personal development.
International
alliances
We've built strong relationships with the best educational institutions in the world.
Research
Experience
The right path to finding better solutions.
Sustainability UTEC
Sustainability documents
Contact:
Giancarlo Marcone
HACS DIRECTOR
gmarcone@utec.edu.pe
Learn
About Us
The university that empowers ingenuity, innovation, and entrepreneurship.
Our Academic
Offer
With our active learning methodology, our students experience engineering from day one.
Ingenuity,
dedication, and
the pursuit
of excellence
Our students' DNA: achieving highest academic achievement and personal development.
International
alliances
We've built strong relationships with the best educational institutions in the world.
Research
Experience
The right path to finding better solutions.
Sustainability UTEC
Sustainability documents
Contact:
Giancarlo Marcone
HACS DIRECTOR
gmarcone@utec.edu.pe
You are here
Dispositivo de microfluídos impreso en 3D para el aislamiento de células tumorales circulantes
Autor:
Luz Pérez Túlich
Laboratorio de Ingeniería de Tejidos y Biología Sintética
Departamento de Bioingeniería
La principal causa de mortalidad asociada al cáncer es la metástasis tumoral, durante la diseminación exitosa, las células tumorales invaden el tejido circundante del tumor primario, se extravasan en los vasos sanguíneos y linfáticos, se trasladan a tejidos distantes, se adaptan al nuevo microambiente y, finalmente, se asientan, proliferan y colonizan para formar metástasis. Debido a que la diseminación ocurre principalmente a través de la sangre, las células tumorales circulantes (CTC) que se han dispersado en la vasculatura y pueden estar en camino a posibles sitios metastásicos son de interés obvio.(Vicki Plaks, Charlotte D. Koopman, 2018), numerosos estudios en la última década han demostrado que las CTC pueden usarse como un marcador para predecir la progresión de la enfermedad y la supervivencia en pacientes metastásicos y posiblemente incluso en pacientes con cáncer en etapa temprana. Los números altos de CTC se correlacionan con una enfermedad agresiva, un aumento de metástasis y una disminución del tiempo hasta la recaída.
Los dispositivos de microfluidos lab-on-a-chip (LOC) han demostrado ser una plataforma prometedora para esta aplicación, debido a una serie de ventajas como tamaño pequeño, bajo costo, bajo consumo de muestras y reactivos, portabilidad y análisis rápido.(Majid Hejaziana, Weihua Lib, 2017)
Chen et al, diseñaron los dispositivos de microfluidos utilizando CAD de modelado 3D (SolidWorks) y se fabricaron utilizando una impresora 3D ProJet 3000HD (sistemas 3D) La impresora permitió una resolución de aproximadamente 40 µm en el plano horizontal del proceso de impresión 3D, y ligeramente mejor (aproximadamente 30 µm) de resolución en dirección vertical, se importaron modelos 3D de los dispositivos de microfluidos en formato de archivo STL (un tipo de archivo estándar para modelos 3D de alta calidad) al software ProJet Accelerator (sistemas 3D). Bajo un control digital preciso, los dispositivos se imprimieron con la cara abierta en contacto con la plataforma de impresión, y se imprimieron en paralelo de modo que la función de trama principal de la impresora atravesará el ancho de los dispositivos en lugar de su longitud para permitir un impresión más uniforme en la sección transversal de las entradas de flujo.
Específicamente, los dispositivos de microfluidos se imprimieron depositando ya sea resina plástica fotocurable o materiales de soporte de cera de fundición capa por capa usando dos boquillas de impresora diferentes (una para el material de construcción fotoplástico y la otra para el material de soporte de cera de sacrificio). Después del proceso de impresión 3D, los dispositivos se sumergieron en aceite mineral de calidad alimentaria a 65 ° C y la cera interna se eliminó con una jeringa. Por último, se utilizó aire a presión para evacuar el aceite mineral restante y secar los dispositivos, luego se bombeó una solución de dopamina (1 mg / ml en tampón Tris 10 mM, pH 8,5) a través del canal durante 1 hora a un caudal constante (1 ml / hora). En solución alcalina (pH 8,5), la dopamina se autopolimerizó en poli dopamina para revestir las estructuras internas ya que proporcionan anclajes covalentes accesibles para la estreptavidina para permitir la inmovilización de anticuerpos anti-EpCAM, por lo que se bombeó una solución de estreptavidina (20 µg / ml en PBS) durante otra hora con el mismo caudal., los sitios activos se bloquearon con albúmina de suero bovino (BSA, 3% en PBS) para evitar la unión inespecífica. Finalmente, introdujeron anticuerpos anti-EpCAM biotinilados (10 µg / mL en PBS) para funcionalizar las áreas de la superficie interna a través de interacciones biotina-estreptavidina. Los dispositivos preparados fueron almacenados en PBS con BSA al 3% en un refrigerador hasta su uso.
Emplearon el módulo FLUENT en el software ANSYS WORKBENCH para realizar simulaciones de captura de células basadas en el método de volumen finito (FVM), el modelo de turbulencia k-ε y el modelo de fase discreta (DPM). Los canales se orientan verticalmente con la entrada hacia abajo y la aceleración gravitacional fue definida como 9,8 m / S2. La fase continua la definieron utilizando agua con una velocidad de entrada de 0,0003 m / S según el caudal de 1 mL / hora. La fase discreta la definieron como partículas sólidas con un diámetro promedio de 20 µm y un caudal total de 9,32 x 10-9 kg / S según la concentración celular de 1 x 106 células / ml. La densidad de la fase discreta se definió aproximadamente como 1060 kg / m3.
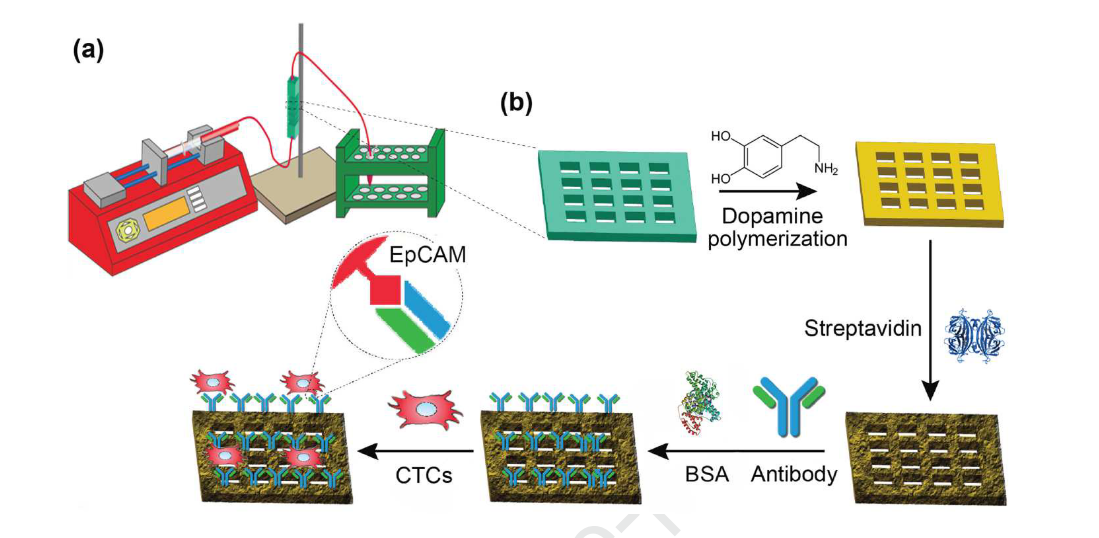
Imagen 1: (a) Ilustración esquemática de la plataforma microfluídica y (b) Representación esquemática de la química de modificación de la superficie y los procedimientos de inmovilización de anticuerpos anti-EpCAM.
Fuente: Chen, J., Liu, C., Wang, X., Sweet, E., Liu, N., & Lin, L (2019).
Para investigar la aplicabilidad general de los dispositivos de microfluidos, se probaron diferentes líneas celulares de cáncer humano (cáncer de mama MCF-7, cáncer de colon SW480, cáncer de próstata PC3 y cáncer de riñón 293T). Todos los MCF-7, SW480 y PC3 son EpCAM positivos con eficiencias de captura resultantes de 92,42 ± 2,00%, 87,74 ± 1,22% y 89,35 ± 1,21%, respectivamente. Las ligeras diferencias entre las eficiencias de captura fueron causadas por diversos grados de expresión de EpCAM en las superficies de cada línea de células tumorales. Como control negativo, se usó la línea celular EpCAM negativa (293T). (Chen et al., 2019)
Bibliografía
1. Chen, J., Liu, C., Wang, X., Sweet, E., Liu, N., & Lin, L. (2019). 3D printed microfluidic devices for circulating tumor cells (CTCs) isolation. Biosensors and Bioelectronics, 111900. https://doi.org/10.1016/j.bios.2019.1119002.
2. Majid Hejaziana, Weihua Lib, N.-T. N. a. (2017). Lab on a chip for continuous-flow magnetic cell separation. RSC Advances, 7(31), 18993–19001. https://doi.org/10.1039/x0xx00000x
3. Vicki Plaks, Charlotte D. Koopman, and Z. W. (2018). Circulating tumor cells. In Pancreatic Cancer (pp. 1325–1360). Springer New York. https://doi.org/10.1007/978-1-4939-7193-0_62
EN UTEC VENIMOS DESARROLLANDO LA TECNOLOGÍA
Y LA INGENIERÍA QUE NECESITA EL MUNDO DEL MAÑANA
Carreras en ingeniería y tecnología que van de la mano con la investigación y la creación de soluciones tecnológicas de vanguardia, comprometidas con las necesidades sociales y la sostenibilidad.
Decide convertirte en el profesional que el mundo necesita. Estudia en UTEC y lleva tu ingenio hacia el futuro.
Déjanos tus datos y suscríbete a nuestros boletines UTEC
-
- STUDY ABROAD
- Studying in Peru
- Living in Peru
- FAQ
- Application Form
- Contact us
-
- EXECUTIVE EDUCATION
- Executive Education
- Short Courses
- Inhouse Courses
- Calendar
