Learn
About Us
The university that empowers ingenuity, innovation, and entrepreneurship.
Our Academic
Offer
With our active learning methodology, our students experience engineering from day one.
Ingenuity,
dedication, and
the pursuit
of excellence
Our students' DNA: achieving highest academic achievement and personal development.
International
alliances
We've built strong relationships with the best educational institutions in the world.
Research
Experience
The right path to finding better solutions.
Sustainability UTEC
Sustainability documents
Contact:
Giancarlo Marcone
HACS DIRECTOR
gmarcone@utec.edu.pe
Learn
About Us
The university that empowers ingenuity, innovation, and entrepreneurship.
Our Academic
Offer
With our active learning methodology, our students experience engineering from day one.
Ingenuity,
dedication, and
the pursuit
of excellence
Our students' DNA: achieving highest academic achievement and personal development.
International
alliances
We've built strong relationships with the best educational institutions in the world.
Research
Experience
The right path to finding better solutions.
Sustainability UTEC
Sustainability documents
Contact:
Giancarlo Marcone
HACS DIRECTOR
gmarcone@utec.edu.pe
You are here
La fabricación de redes vasculares en tejidos cultivados: un reto, un paso a la vez
La medicina regenerativa ha dado un gran paso de avance para la fabricación de tejidos y órganos cuyo objetivo es la sustitución, el reemplazo o el implante para recuperar o mejorar funciones que han sido perdidas, gracias al aporte significativo que brindan técnicas tales como la ingeniería de tejidos y la bioimpresión 3D, e incluso la bioimpresión 4D, en donde los productos impresos cambian en el tiempo.
En la fabricación de tejidos a partir de cultivos celulares se han dado importantes avances en diversos órganos o tejidos tales como la piel, el cartílago hialino y el hueso, entre otros [1]. La bioimpresión no se ha quedado atrás, e incluso ha superado a la ingeniería de tejidos en el sentido de crear tejidos u órganos tridimensionales, superando la limitación bidimensional del tejido cultivado.
No obstante, ambas técnicas encuentran un reto común que ha impedido la concepción de órganos o tejidos más grandes, más gruesos y funcionales: crear y fabricar su vascularización en las diversas escalas jerárquicas y coberturas que fisiológicamente se encuentran en los tejidos u órganos naturales. Es bien sabido que la salud y funcionalidad de un tejido u órgano vascularizado dependen considerablemente de la irrigación sanguínea que aporta oxígeno y nutrientes a todos los puntos del tejido, así como el suministro de células y señales celulares necesarios para el metabolismo y funcionamiento de estos. Una pobre o nula vascularización pronto llevaría al tejido afectado a la necrosis.
La red jerárquica de vasos sanguíneos en el ser humano la componen conductos con diferentes dimensiones, compuestos por diferentes capas, que poseen ramificaciones cuyo diámetro se va haciendo más pequeño a medida que estos se alejan del corazón y van difundiendo la sangre a los diferentes tejidos u órganos. Las arterias y las venas son los conductos más grandes cuyos diámetros oscilan entre 1 a 27 mm en el caso de las arterias [2] y de 1 a 6 mm en el caso de las venas [3], seguidos de las arteriolas y las vénulas, y finalmente de los capilares, los vasos más pequeños, cuyo diámetro es del orden de 5 µm [4]. Vale la pena mencionar que la ingeniería vascular solo considera las arterias hasta una dimensión máxima de 10 mm [4].
En la actualidad, a través de las técnicas de fabricación artificial solo se han logrado obtener ensayos preclínicos exitosos con tejidos u órganos que no requieren redes vasculares, como la piel o el cartílago. Más aún, estos ensayos exitosos solo se hacen en animales pequeños, por la facilidad de control sobre su metabolismo y por los rápidos resultados gracias a sus procesos biológicos acelerados comparados con los del hombre. Más aún, el mayor logro clínico obtenido al día de hoy es la reciente bioimpresión de una oreja que fue implantada en una mujer adulta. Esta oreja fue impresa con una biotinta cargada con condrocitos obtenidos de la misma paciente [5].
Actualmente existen dos enfoques diferentes para la fabricación multiescalar de redes vasculares, uno a partir de aplicaciones tecnológicas o de ingeniería y otro a partir de formas naturales o biológicas. La revista Nature Reviews Materials en su versión en línea de junio de 2022 publicó una revisión sobre la actualidad de estos enfoques, sus limitaciones y proyecciones futuras [4]. Estos temas se presentan brevemente en el presente artículo.
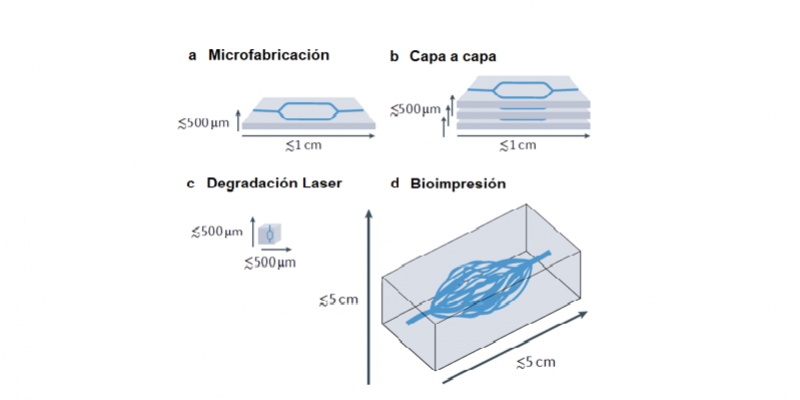
En el enfoque por aplicaciones tecnológicas o de ingeniería se encuentran técnicas como la microfabricación bidimensional o su extensión tridimensional por apilamiento (permiten crear pequeñas estructuras moldeadas con pequeños canales a microescala para el paso de fluidos, figuras 1a y 1b), la escritura laser sobre matrices tridimensionales (técnica de creación de microcanales a partir de la degradación o sinterización de polímeros fotosensibles que conforman la estructura vascular por medio de litografía laser, figura 1c), y la bioimpresión (donde se crean andamios tridimensionales con microcanales que más tarde conformarán vasos vasculares, figura 1d).
Figura 1. Enfoques de ingeniería para la fabricación de redes vasculares: microfabricación (a), apilamiento de microfabricaciones capa a capa (b), degradación por litografía laser (c),
y bioimpresión 3D (d). Adaptado de [4].
En cuanto a la fabricación de redes vasculares por medios naturales o biológicos, que se basa en la capacidad celular de generar tejidos con la calidad y la morfología requeridas, se enumeran el autoensamblaje de redes vasculares (a partir de agregar células endoteliales en andamios con hidrogeles de polímeros naturales o sintéticos, figura 2a) y los organoides (pequeños órganos de hasta 150 µm de diámetro donde se forma vascularización autoensamblada con propiedades similares a los tejidos naturales, figura 2b).
Estos enfoques son capaces de fabricar redes vasculares que pueden irrigar y nutrir los tejidos fabricados artificialmente. Sin embargo, su implementación no es suficiente para producir tejidos u órganos tridimensionales con dimensiones grandes similares a sus equivalentes naturales, pues actualmente presentan limitaciones considerables. En el caso de los enfoques ingenieriles, la limitación es mayormente de resolución al no poder fabricar vasos sanguíneos de diámetros muy pequeños (caso de las arteriolas, vénulas y vasos capilares). Solamente en el caso de la escritura laser pueden alcanzarse resoluciones a escala de los vasos capilares humanos más pequeños (5 µm). No obstante, es una técnica solamente práctica para pequeños volúmenes, haciéndola muy ineficiente para extensas redes vasculares como las presentes en los órganos naturales.
Figura 2. Enfoques naturales o biológicos para la fabricación de redes vasculares: autoensamblaje celular (a), y organoides con redes vasculares autoensambladas (b). Adaptado de [4].
Las limitaciones en el caso de los enfoques biológicos están relacionadas con la inestabilidad que poseen las redes autoensambladas únicamente con células endoteliales, ya que estas necesitan de una combinación de otras células (mesenquimales o estromales) y otras condiciones que permitan crear una red de vasos reforzados y soportados por otros tejidos. Cuando las redes autoensambladas se forman en pequeños organoides, estos por lo general requieren ser implantados in vivo, por lo pronto en pequeños animales, para poder reproducir una red vascular jerárquica (con vasos entre 5 a 50 µm) con capacidad de irrigar adecuadamente el tejido huésped donde se encuentra. En este sentido, Yamamura et al. encontraron que la rigidez del hidrogel base del autoensamblaje tiene un efecto directo en el tamaño de los vasos capilares formados, donde un gel más rígido estimula la formación de vasos capilares más grandes mientras que un gel menos rígido estimula la formación de delicados vasos capilares [6].
Más allá de las limitaciones expuestas, aspectos tales como generar biológicamente una red vascular con vascularización jerárquica controlada (desde las arterias y venas hasta los capilares) o generar tecnológicamente vasos sanguíneos con todas sus capas (no solo la capa endotelial interna, sino la capa muscular media y la capa externa adventicia o de colágeno) están apenas en proceso de investigación y desarrollo. Una propuesta es la de crear “preformas” jerárquicas in vitro que incluyen patrones de posicionamiento espacial de células endoteliales y fibras de colágeno, las cuales madurarán como redes vasculares jerárquicas y amplias una vez puestas in vivo [4].
También se ha visto que el subtipo de células empleadas puede marcar diferencias en la morfología y desempeño del vaso, pues las células pueden generan características propias favorables al tipo de órgano del que provienen (fenotipo y función celular), por lo que un aspecto a tener en cuenta en la ingeniería vascular es el de incluir poblaciones heterogeneas de células endoteliales y de soporte que potencialmente generen redes vasculares con afinidad funcional con su órgano huésped.
A su vez, dado que las células endoteliales y las células sanguíneas interactúan directamente y de formas particulares ante diferentes escenarios, como formar inflamación, coagulación o respuesta inmunitaria, entre otras, la presencia o no de las células sanguíneas circundantes en las redes vasculares marca una gran diferencia a la hora de implementar un enfoque in vitro o in vivo de ingeniería vascular.
Al igual que otros tejidos, las redes vasculares están sujetas a procesos de remodelamiento que pueden cambiar las dimensiones de los vasos vasculares y su microestructura en función de la demanda mecánica que estos experimenten, representada en las presiones variables del flujo sanguíneo (pulsátiles o estáticas) y las fuerzas cortantes del flujo, cuyos efectos primarios se reflejan en el estiramiento cíclico o estático, en direcciones radial y axial, de las paredes vasculares. En consecuencia, puede afirmarse que los estímulos mecánicos tienen efectos sobre la tasa de angiogénesis tanto en la fabricación tecnológica como biológica de redes vasculares.
En conclusión, se observa que la ingeniería vascular está avanzando para lograr fabricar redes vasculares densas y extensas que permitan irrigar volúmenes grandes de tejidos creados en el laboratorio, con la esperanza de superar esta barrera y obtener más temprano que tarde tejidos y órganos sintéticos funcionales para ser implantados en pacientes que los requieran.
Bibliografía
[1] Ozbolat, I. T., y Peng, W., (2017). Applications of 3D Bioprinting. En: Ozbolat, I. T. (Editor) (2017). 3D Bioprinting, Fundamentals, Principles and Applications, 271-312. Academic Press. https://doi.org/10.1016/B978-0-12-803010-3.00009-3
[2]Hartley, M. C., Langan,E. M., Cull, D. L., Taylor, S. M., Carsten, C. G., y Blackhurst, D. W. (2009). Evaluación del diámetro de la aorta torácica descendente proximal con la edad: implicaciones para la implantación de una endoprótesis de aorta torácica. Anales de Cirugía Vascular 23(5), 705-710. https://doi.org/10.1016/j.acvsp.2009.11.005
[3]Berardi, H., y Ciccioli, A. (2015). Examen Doppler de la insuficiencia venosa de miembros inferiores: consenso entre especialistas. Revista Argentina de Radiología 79(2), 72-79. https://doi.org/10.1016/j.rard.2014.10.008
[4]O’Connor, C., Brady, E., Zheng, Y., Moore, E., y Stevens, K.R. (2022). Engineering the multiscale complexity of vascular networks. Nature Reviews Materials. https://doi.org/10.1038/s41578-022-00447-8
[5] 3DBio Therapeutics (2022). 3DBio Therapeutics and the Microtia-Congenital Ear Deformity Institute Conduct Human Ear Reconstruction Using 3D-Bioprinted Living Tissue Implant in a First-in-Human Clinical Trial. Comunicado de prensa consultado el 20 de julio de 2022 en https://ir.3dbiocorp.com/2022/06/02/3dbio-therapeutics-and-the-microtia-...
[6]Yamamura, N., Sudo, R., Ikeda, M. y Tanishita, K. (2007). Effects of the mechanical properties of collagen gel on the in vitro formation of microvessel networks by endothelial cells. Tissue Engineering 13, 1443–1453.
Autor : Andres Arias - Profesor a Tiempo Completo Dpto. Bioingeniería
EN UTEC VENIMOS DESARROLLANDO LA TECNOLOGÍA
Y LA INGENIERÍA QUE NECESITA EL MUNDO DEL MAÑANA
Carreras en ingeniería y tecnología que van de la mano con la investigación y la creación de soluciones tecnológicas de vanguardia, comprometidas con las necesidades sociales y la sostenibilidad.
Decide convertirte en el profesional que el mundo necesita. Estudia en UTEC y lleva tu ingenio hacia el futuro.
Déjanos tus datos y suscríbete a nuestros boletines UTEC
-
- STUDY ABROAD
- Studying in Peru
- Living in Peru
- FAQ
- Application Form
- Contact us
-
- EXECUTIVE EDUCATION
- Executive Education
- Short Courses
- Inhouse Courses
- Calendar