Learn
About Us
The university that empowers ingenuity, innovation, and entrepreneurship.
Our Academic
Offer
With our active learning methodology, our students experience engineering from day one.
Ingenuity,
dedication, and
the pursuit
of excellence
Our students' DNA: achieving highest academic achievement and personal development.
International
alliances
We've built strong relationships with the best educational institutions in the world.
Research
Experience
The right path to finding better solutions.
Sustainability UTEC
Sustainability documents
Contact:
Giancarlo Marcone
HACS DIRECTOR
gmarcone@utec.edu.pe
Learn
About Us
The university that empowers ingenuity, innovation, and entrepreneurship.
Our Academic
Offer
With our active learning methodology, our students experience engineering from day one.
Ingenuity,
dedication, and
the pursuit
of excellence
Our students' DNA: achieving highest academic achievement and personal development.
International
alliances
We've built strong relationships with the best educational institutions in the world.
Research
Experience
The right path to finding better solutions.
Sustainability UTEC
Sustainability documents
Contact:
Giancarlo Marcone
HACS DIRECTOR
gmarcone@utec.edu.pe
You are here
Ingeniería de proteínas
En los últimos años se ha vuelto común escuchar hablar a científicos, ingenieros e innovadores en general sobre la Biología Sintética y su gran potencial para cambiar al mundo. Muchas Start-Ups basan sus ideas en su fundamento de ver a los diferentes componentes del ADN, como genes, promotores, terminadores, y otras partes, como piezas desmontables, o bio-ladrillos, que pueden ser combinadas de diferentes formas para lograr que un organismo realice el proceso que se desea, como por ejemplo que brille al detectar un contaminante en un río, o que potencie la degradación de algún material indeseable en alta mar. Sin embargo, poco se viene hablando sobre cómo estos conceptos también se pueden aplicar a las proteínas; usualmente definimos al gen en su totalidad como un bio-ladrillo que es movido completo de un constructo genético a otro, y no vemos a su producto final, la proteína, como otra combinación de piezas que podría ser explotable.
PROTEÍNAS 101 - Estructura y Dominios
Una proteína es una secuencia de aminoácidos, de la misma manera que el ADN es una secuencia de nucleótidos, en ambos casos estas secuencias pueden ser representadas por letras, pero mientras que el ADN utiliza una secuencia de 4 letras, las proteínas son un poco más versátiles, teniendo naturalmente 20 aminoácidos diferentes. Esto le brinda a las proteínas una mayor versatilidad, la cual le brinda propiedades fisicoquímicas muy específicas a las millones de proteínas que existen en la naturaleza.

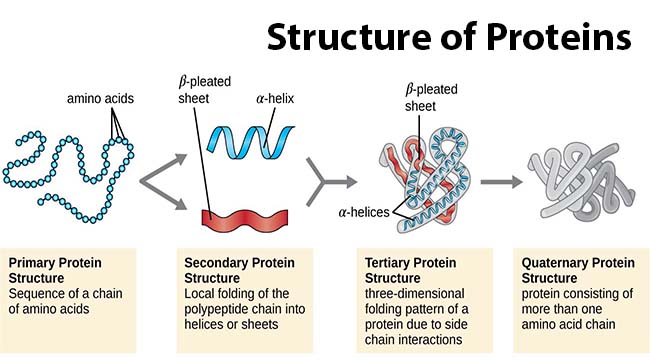
Estos 20 aminoácidos están compuestos por una región que es igual en todos, y que participa en la formación de enlaces químicos entre aminoácidos, y una región específica de cada uno, esta región es la que caracteriza al aminoácido como polares, apolares, hidrofóbicos o hidrofílicos, alifáticos, aromáticos, o cargados positiva o negativamente. A la unión de estos en secuencia se le conoce como estructura primaria, y es básicamente como estos van saliendo de los ribosomas al ser traducidos a partir de un ARN mensajero.
Pero las proteínas no son simples hebras con aminoácidos uno tras otro, estas están compuestas de cientos a miles de aminoácidos que en base a sus residuos (las partes específicas de cada uno) van a formar estructuras más complejas. Las estructuras más básicas son las que se conocen como estructura secundaria, aquí los aminoácidos toman formas bastante comunes, las más conocidas son las hélices alfa y las hojas beta, estas se dan como consecuencia, primero del orden de los enlaces peptídicos entre aminoácidos, que dependiendo de la forma y tamaño de sus residuos pueden permanecer en una determinada forma ya que se restringe su capacidad de girar alrededor del enlace; y por otro lado,de las interacciones entre los residuos de los aminoácidos que pueden deberse a puentes de hidrógeno, atracciones entre los residuos cargados. Estas estructuras se combinan en diferentes proteínas para dar lugar a la formación de motifs, que pueden tener características muy específicas en las proteínas, como son los famosos dedos de Zinc que participan en la unión de proteínas al ADN.
La estructura terciaria de las proteínas involucra ya a toda la proteína, o monómero de esta, hace referencia al plegamiento que define la forma, o formas, que tiene la proteína madura. Esta estructura es dependiente de interacciones de mayor fuerza entre grupos de aminoácidos, como las interacciones hidrofóbicas que estabilizan las regiones internas, o los puentes disulfuro que permiten una unión muy estable entre dos aminoácidos de cisteína en lugares diferentes de la secuencia de aminoácidos. Además, las proteínas pueden tener una estructura cuaternaria, que se aplica a proteínas que necesitan de varias copias del mismo tipo, o tipos diferentes para funcionar, o para potenciar su funcionamiento.
Habiendo definido las diferentes estructuras de las proteínas podemos pasar a hablar de dominios. Un dominio proteico es una región grande de esta que cumple un rol específico, como unirse específicamente a otra proteína, o parte de alguna membrana biológica; realizar una función catalítica como la fosforilación, que permite activar a muchas proteínas al interior de la célula; o funcionar como un switch que al recibir un estímulo que puede ser la interacción con un metal pesado, una molécula de azúcar, o incluso recibir un rayo de luz de una longitud de onda específica, va a cambiar su forma activando o inactivando a toda la proteína.
Cuando analizamos diferentes proteínas vamos a ver que estas pueden tener varios dominios, y en proteínas con funciones similares vemos que algunos de estos dominios se repiten pues cumplen la misma función, con diferencias que dependen de la localización en la célula o su interacción con diferentes grupos de proteínas. Estos dominios, aunque sean los mismos, no son completamente iguales, presentan diferencias en su secuencia que les permite tener especificidad respecto a con qué moléculas van a interactuar, y es aquí donde es posible aprovecharlos como si fueran bloques intercambiables al igual que los bio-ladrillos.
Si bien la estructura de las proteínas es compleja y una alteración en el gen que las produce puede afectar su función o inutilizarlas completamente, es posible intercambiar porciones de estas con funciones específicas, a.k.a. los dominios. Yo puedo tener un receptor de membrana A que interactúa con un sustrato B a través de su dominio receptor extracelular, e interactúa con una vía de señalización específica a través de sus dominios intracelulares, y un receptor H que puede ser de otro tipo celular o incluso de otra especie, que interactúa con un sustrato J y activa una vía de señalización diferente. Si yo quisiera podría cambiar el dominio receptor de la primera proteína por el dominio receptor de la segunda y tener como resultado a una proteína que reconoce al sustrato J, pero activa la vía de señalización que normalmente activa el sustrato B.
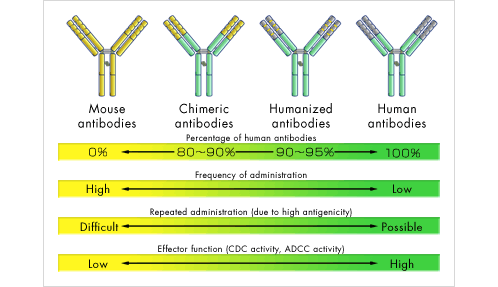
Un caso muy conocido son los anticuerpos quiméricos y los anticuerpos humanizados, que son producidos por ratones, pero tienen regiones de anticuerpos humanos para evitar que estos sean reconocidos como elementos extraños al entrar en contacto con células humanas. En otros casos, como la activación de quorum sensing, podría ser posible cambiar el dominio que reconoce a la molécula autoinductora por otros que reconozca diferentes sustratos, como fragmentos de pared celular de algunos microorganismos patógenos, metales pesados, o moléculas utilizadas como marcadores en algunas enfermedades; generando así métodos diagnósticos de bajo costo y alta especificidad, ya que si bien realizar todo el cambio a nivel molecular de estos receptores tiene un costo elevado, una vez implementado basta con poner a los microorganismos en un medio de cultivo simple para generar billones de estos pequeños detectores en un tiempo tan corto como 24 horas.
CONOCE MÁS SOBRE BIOINGENIERIA EN UTEC ![]() Y VIVE LA INGENIERIA
Y VIVE LA INGENIERIA ![]() Bioingenieria
Bioingenieria ![]()
EN UTEC VENIMOS DESARROLLANDO LA TECNOLOGÍA
Y LA INGENIERÍA QUE NECESITA EL MUNDO DEL MAÑANA
Carreras en ingeniería y tecnología que van de la mano con la investigación y la creación de soluciones tecnológicas de vanguardia, comprometidas con las necesidades sociales y la sostenibilidad.
Decide convertirte en el profesional que el mundo necesita. Estudia en UTEC y lleva tu ingenio hacia el futuro.
Déjanos tus datos y suscríbete a nuestros boletines UTEC
-
- STUDY ABROAD
- Studying in Peru
- Living in Peru
- FAQ
- Application Form
- Contact us
-
- EXECUTIVE EDUCATION
- Executive Education
- Short Courses
- Inhouse Courses
- Calendar
