Learn
About Us
The university that empowers ingenuity, innovation, and entrepreneurship.
Our Academic
Offer
With our active learning methodology, our students experience engineering from day one.
Ingenuity,
dedication, and
the pursuit
of excellence
Our students' DNA: achieving highest academic achievement and personal development.
International
alliances
We've built strong relationships with the best educational institutions in the world.
Research
Experience
The right path to finding better solutions.
Sustainability UTEC
Sustainability documents
Contact:
Giancarlo Marcone
HACS DIRECTOR
gmarcone@utec.edu.pe
Learn
About Us
The university that empowers ingenuity, innovation, and entrepreneurship.
Our Academic
Offer
With our active learning methodology, our students experience engineering from day one.
Ingenuity,
dedication, and
the pursuit
of excellence
Our students' DNA: achieving highest academic achievement and personal development.
International
alliances
We've built strong relationships with the best educational institutions in the world.
Research
Experience
The right path to finding better solutions.
Sustainability UTEC
Sustainability documents
Contact:
Giancarlo Marcone
HACS DIRECTOR
gmarcone@utec.edu.pe
You are here
El estiramiento celular y la superelasticidad
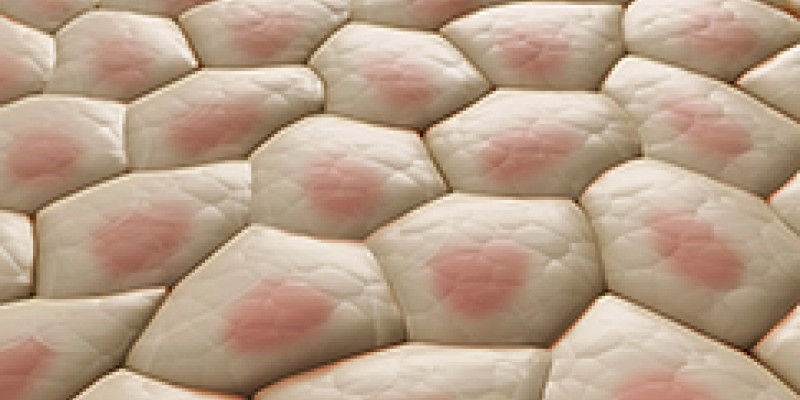
Los tejidos epiteliales permiten funciones fisiológicas clave, como morfogénesis, transporte, secreción y absorción. Para realizar estas funciones, los epitelios a menudo adoptan una arquitectura tridimensional (3D) que consiste en una lámina celular curvada que encierra un lumen lleno de líquido presurizado. La pérdida de esta arquitectura 3D está asociada con defectos de desarrollo, condiciones inflamatorias y cáncer. La adquisición de una forma 3D por láminas epiteliales requiere un control estricto de la deformación celular, la tensión mecánica y la presión luminal. Se desconoce la forma en que estas variables mecánicas se sintonizan para esculpir los epitelios 3D, porque las técnicas actuales para mapear la mecánica epitelial se restringen en gran medida a capas bidimensionales (2D) sembradas en un sustrato plano o colocadas libremente. .
Cuando nuestra piel sufre un corte, se rompe en el sitio de la herida. Esto se debe a que la superficie de la piel, está sujeta a tensión, la cual ayuda a limitar el tamaño y esculpir la forma de los órganos, una célula puede generar y resistir tensiones. En la célula la mayor concentración de microfilamentos del citoesqueleto se encuentra justo por debajo de la membrana plasmática, en donde una de sus funciones es mantener la forma de la célula y transmitir fuerza, los filamentos de actina son movidos por los de miosina para generar fuerzas contráctiles que regulan la forma celular. Los sitios de adhesión que unen las células pueden transmitir esta fuerza entre las células y hacer que la tensión se acumule en todo el tejido, sin embargo, las células bajo tensión no suelen romperse, porque sus propiedades materiales les permiten resistir esta tensión. Si las células bajo tensión sufren deformaciones a pequeña escala, los cambios resultantes son principalmente elásticos y existe una relación lineal entre un aumento de la tensión y un aumento de la deformación.
En las deformaciones a gran escala, las células pueden entrar en un estado denominado plasticidad, en el que la ruptura de las uniones entre los filamentos del citoesqueleto conducen a deformaciones irreversibles que impiden la recuperación celular completa, incluso si se libera el estrés asociado. Las células bajo tensión que sufren deformaciones a gran escala cambian de estar en un estado elástico para entrar a uno en el cual las células se alargan, pasando a un estado que se le conoce como superelastico, en el que las células se alargan sin requerir un aumento de la tensión, siendo estas deformaciones reversibles.
En estudios previos las fuerzas externas aplicadas lo fueron por segundos o minutos Latorre y sus colegas estudiaron cambios que ocurren en las células en varias horas que son sometidas a una tensión; las cuales en rápido aumento a menudo se rompen, incluso a niveles de tensión bajos pero si las células son sometidas a una tensión, incluso 100 veces mayor en sólo unos minutos, las células pueden resistirse, si las células se estiran a su propio ritmo, como si se extendieran lentamente. sobre una superficie.
Cultivando células de riñón canino Madin-Darby (MDCK) en un sustrato deformable (polidimetilsiloxano - PDMS), que fue homogéneamente cubierto con fibronectina excepto en micropatrones en áreas no adhesivas de una geometría precisa, los autores enfocados en la corteza celular; una malla de filamentos de actina y miosina que forma una capa delgada debajo de la membrana celular. El grosor de la corteza disminuyó luego del estiramiento celular, lo que sugiere que podría requerirse una corteza lo suficientemente gruesa para permitir la elasticidad celular, y aumentar la posibilidad de que, por debajo de un cierto grosor, la corteza deje de resistir la tensión y comience a "fluir". Sin embargo, los autores no pudieron identificar una transición clara en la estructura de la corteza entre la que se encuentra en un estado elástico o en un estado superelástico.
El entrecruzamiento de los filamentos de actina garantiza que los componentes de la red de actina se conecten con éxito y que funcionen como un todo, en lugar de como numerosas unidades independientes. Es posible, que a medida que la corteza se adelgaza durante el estiramiento celular, se alcance un punto cuando está conectividad de la red se pierda y las partes desconectadas de la red comiencen a separarse bajo tensión. Si esto es cierto, la densidad de las proteínas de entrecruzamiento por infiltración podría ser un factor clave en la transición hacia la superelasticidad.
Un proceso de elongación celular que no requiera un aumento de la fuerza para aumentar la deformación terminará cuando se produzca la ruptura. Latorre y sus colegas notaron que cuando la capa de células se rompió, aparecieron agujeros entre las células adyacentes. El agua a presión dentro de la cúpula escapó a través del punto de ruptura, la cúpula se colapsó y las células estiradas volvieron a su tamaño inicial sin estiramiento.
Las Uniones adhesivas; las cuales unen las células entre sí, son los puntos de debilidad,lo cual es consistente con las observaciones de la ruptura del tejido realizadas mediante monocapas celulares estiradas externamente. Los filamentos intermedios han sido poco estudiados en comparación con los filamentos de actina debido a su dinámica de rotación lenta y la ausencia de herramientas experimentales convenientes, como los medicamentos, que pueden desmontarlos. Sin embargo, su importancia en la mecánica celular está ganando reconocimiento. Los filamentos intermedios contribuyen sustancialmente a la elasticidad de las células estiradas y pueden soportar niveles extensos de estiramiento.
Usando un láser para cortar haces de filamentos intermedios en células estiradas en un estado de superelasticidad, se descubrió que esto inducía la relajación celular, una liberación de estrés y un alargamiento que aumentaba el área celular. Esto sugiere que los filamentos intermedios podrían proteger a las células superelásticas de sufrir una deformación ilimitada actuando como resortes que resisten la tensión en altos niveles de deformación. En tales circunstancias, la capacidad de los filamentos intermedios para volver a su longitud habitual después de ser estirados podría incluso permitir que dichas células recuperen su forma inicial cuando se libera la tensión. El trabajo de Latorre y sus colegas ha revelado una relación más compleja entre el tamaño de la célula y las fuerzas que experimentan las células de lo que se apreciaba anteriormente.
Cultivos celulares sometidos a procesos de deformación
Bibliografía
Latorre, et al. 2018 Active superelasticity in three dimensional epithelia of controlled shape. Nature.
CONOCE MÁS SOBRE BIOINGENIERIA EN UTEC ![]() Y VIVE LA INGENIERIA
Y VIVE LA INGENIERIA ![]() Bioingenieria
Bioingenieria ![]()
EN UTEC VENIMOS DESARROLLANDO LA TECNOLOGÍA
Y LA INGENIERÍA QUE NECESITA EL MUNDO DEL MAÑANA
Carreras en ingeniería y tecnología que van de la mano con la investigación y la creación de soluciones tecnológicas de vanguardia, comprometidas con las necesidades sociales y la sostenibilidad.
Decide convertirte en el profesional que el mundo necesita. Estudia en UTEC y lleva tu ingenio hacia el futuro.
Déjanos tus datos y suscríbete a nuestros boletines UTEC
-
- STUDY ABROAD
- Studying in Peru
- Living in Peru
- FAQ
- Application Form
- Contact us
-
- EXECUTIVE EDUCATION
- Executive Education
- Short Courses
- Inhouse Courses
- Calendar